Φαρμακοδυναμική
Φαρμακοθεραπευτική κατηγορία: ψυχοαναληπτικά, αναστολέας χολινεστεράσης
Κωδικός ATC: Ν06DΑ03
Η rivastigmine είναι ένας αναστολέας της ακετυλο-και βουτυρυλχολινεστεράσης καρβαμικού τύπου, που πιστεύεται ότι διευκολύνει τη χολινεργική νευροδιαβίβαση επιβραδύνοντας την αποικοδόμηση της ακετυλοχολίνης που απελευθερώνεται από όσους χολινεργικούς νευρώνες διατηρούν τη λειτουργικότητά τους. Έτσι, η rivastigmine ενδέχεται να έχει βελτιωτική δράση σε γνωσιακά ελλείμματα χολινεργικής μεσολάβησης στην άνοια σχετιζόμενη με τη νόσο Alzheimer.
Η rivastigmine αλληλεπιδρά με τα ένζυμα-στόχους της σχηματίζοντας σύμπλοκο ομοιοπολικού δεσμού, με αποτέλεσμα την προσωρινή αδρανοποίηση των ενζύμων. Σε νεαρούς υγιείς ανθρώπους, μία από του στόματος δόση 3 mg μειώνει τη δράση της ακετυλοχολινεστεράσης (AChE) στο εγκεφαλονωτιαίο υγρό κατά περίπου 40% εντός των πρώτων 1,5 ωρών μετά τη χορήγηση. Η δραστικότητα του ενζύμου επανέρχεται στα αρχικά της επίπεδα περίπου 9 ώρες μετά την επίτευξη του μέγιστου ανασταλτικού αποτελέσματος. ΠΣε ασθενείς με Νόσο Alzheimer, η αναστολή της AChE στο εγκεφαλονωτιαίο υγρό από την από του στόματος rivastigmine ήταν δοσοεξαρτώμενη έως τα 6 mg χορηγούμενη δύο φορές ημερησίως, που είναι και η μέγιστη δόση που έχει δοκιμασθεί. Η αναστολή της δράσης της βουτυρυλχολινεστεράσης στο εγκεφαλονωτιαίο υγρό 14 ασθενών με Νόσο Alzheimer με αγωγή με από του στόματος rivastigmine ήταν όμοια με την αναστολή της δράσης της AChE.
Κλινικές μελέτες στην άνοια Alzheimer
Η αποτελεσματικότητα των διαδερμικών εμπλάστρων Exelon σε ασθενείς με άνοια Alzheimer έχει καταδειχθεί σε μια 24 εβδομάδων βασική διπλή-τυφλή ελεγχόμενη με εικονικό φάρμακο μελέτη με ανοικτής φάσης επέκταση και σε μια 48 εβδομάδων διπλή-τυφλή συγκριτική μελέτη.
24 εβδομάδων ελεγχόμενη με εικονικό φάρμακο μελέτη
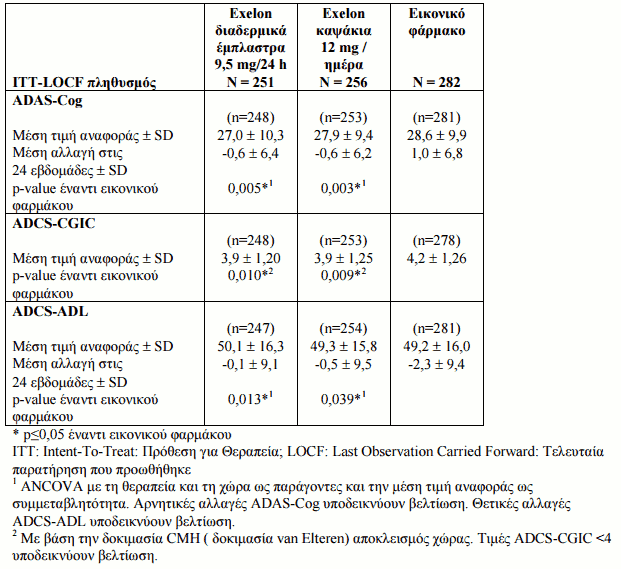
Οι ασθενείς που έλαβαν μέρος στην ελεγχόμενη με εικονικό φάρμακο μελέτη είχαν βαθμολογία MMSE (Εξέταση Ελάχιστης-Νοητικής Κατάστασης) 10-20. Η αποτελεσματικότητα έχει καταδειχθεί με την χρήση τριών ανεξάρτητων, για συγκεκριμένους τομείς εργαλείων αξιολόγησης που αξιολογήθηκαν σε ανά περιοδικά διαστήματα στη διάρκεια των 24 εδβομάδων θεραπείας. Στα εργαλεία αυτά συμπεριλαμβάνονται: η ADAS-Cog (Alzheimer's Disease Assessment Scale - Cognitive subscale, μια δοκιμασία με βάση την απόδοση, που αποτελεί μέτρο της γνωστικής λειτουργίας), η ADCS-CGIC (Alzheimer's Disease Cooperative Study - Clinician's Global Impression of Change, μια πλήρης ολική αξιολόγηση του ασθενούς από τον ιατρό, όπου λαμβάνονται υπ'όψιν στοιχεία που δίνονται από το άτομο που φροντίζει τον ασθενή) και η ASCS-ADL (Alzheimer's Disease Cooperative Study - Activities of Daily Living, μια αξιολόγηση από το άτομο που φροντίζει τον ασθενή των δραστηριοτήτων της καθημερινής ζωής στις οποίες συμπεριλαμβάνονται η προσωπική υγιεινή, η λήψη τροφής, το ντύσιμο, οι δουλειές του νοικοκυριού όπως τα ψώνια, η διατήρηση της ικανότητας προσανατολισμού στο περιβάλλον, καθώς και η συμμετοχή σε δραστηριότητες που σχετίζονται με την ικανότητα χειρισμού χρημάτων κ.λ.π.). Τα αποτελέσματα των τριών αυτών εργαλείων αυτών κατά τις 24 εβδομάδες, συνοψίζονται στον Πίνακα 2.
Πίνακας 2:
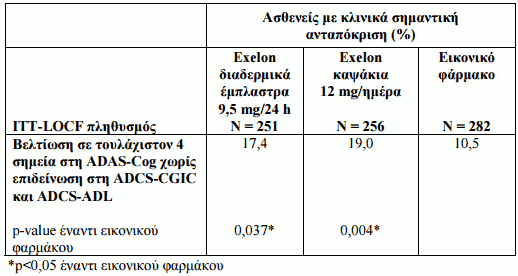
Τα κλινικά σημαντικά αποτελέσματα ανταπόκρισης σε αυτή την ελεγχόμενη με εικονικό φάρμακο μελέτη 24 εβδομάδων παρουσιάζονται στον Πίνακα 4. Κλινικά σημαντική βελτίωση ορίστηκε a priori ως η βελτίωση σε τουλάχιστον 3 σημεία στην ADAS-Cog, μη επιδείνωση στην ADCS-CGIC και μη επιδείνωση στην ADCS-ADL.
Πίνακας 3:
Όπως υποστηρίζεται από το διαχωριστικό μοντέλο, διαδερμικά έμπλαστρα 9,5 mg/24 h κατέδειξαν έκθεση ισοδύναμη με αυτή η οποία παρέχεται από μια από του στόματος χορήγηση 12 mg/ημέρα.
48 εβδομάδων συγκριτική ελεγχόμενη μελέτη
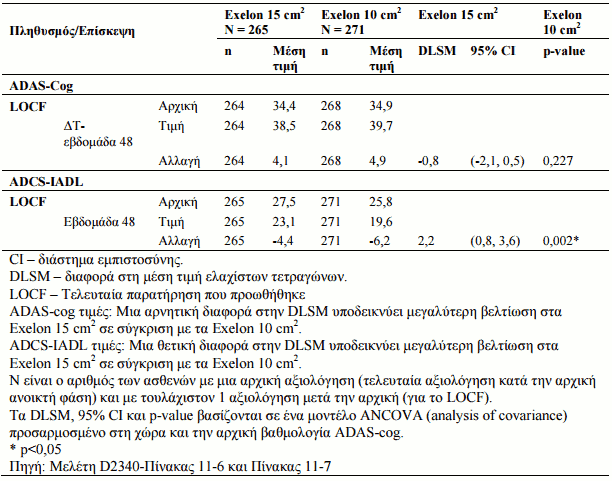
Οι ασθενείς που έλαβαν μέρος στη συγκριτική ελεγχόμενη μελέτη είχαν μια αρχική βαθμολογία MMSE (Εξέταση Ελάχιστης-Νοητικής Κατάστασης) 10-24. Η μελέτη σχεδιάστηκε για να συγκρίνει την αποτελεσματικότητα των διαδερμικών εμπλάστρων 13,3 mg/24 h σε σχέση με τα διαδερμικά έμπλαστρα 9,5 mg/24 h κατά τη διάρκεια μιας 48 εβδομάδων διπλής-τυφλής θεραπευτικής φάσης σε ασθενέις με νόσο Alzheimer που παρουσιάσαν λειτουργική και γνωστική έκπτωση μετά από μια αρχική ανοικτή θεραπευτική φάση 24-48 εβδομάδων ενόσω λάμβαναν μια δόση συντήρησης με διαδερμικό έμπλαστρο των 9,5 mg/24 h. Η λειτουργική έκπτωση εκτιμήθηκε από τον ερευνητή και η γνωστική έκπτωση καθορίστηκε ως μια μείωση της βαθμολογιας MMSE κατά >2 βαθμούς από την προηγούμενη επίκεψη ή >3 βαθμούς από την αρχική. Η αποτελεσματικότητα έχει καταδειχθεί με την χρήση των ADAS-Cog (Alzheimer's Disease Assessment Scale - Cognitive subscale, μια δοκιμασία με βάση την απόδοση, που αποτελεί μέτρο της γνωστικής λειτουργίας), και ADCS-IADL (Alzheimer's Disease Cooperative Study - Instrumental Activities of Daily Living) που αξιολογεί καθοριστικής σημασίας δραστηριότητες οι οποίες συμπεριλαμβάνουν τη διαχείριση χρημάτων, προετοιμασία γεύματος, ψώνια, διατήρηση της ικανότητας προσανατολισμού στο περιβάλλον, ικανότητα να παραμείνει χωρίς επίβλεψη. Τα αποτελέσματα των δύο αυτών εργαλείων αξιολόγησης κατά τις 48 εβδομάδες, συνοψίζονται στον Πίνακα 4.
Πίνακας 4:
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων έχει δώσει απαλλαγή από την υποχρέωση υποβολής των αποτελεσμάτων των μελετών με το Exelon σε όλες τις υποκατηγορίες του παιδιατρικού πληθυσμού στην θεραπεία της άνοιας Alzheimer (βλ. παράγραφο 4.2 για πληροφορίες σχετικά με την παιδιατρική χρήση).
Φαρμακοκινητική
Απορρόφηση
Η απορρόφηση της rivastigmine από τα Exelon διαδερμικά έμπλαστρα είναι αργή. Μετά την πρώτη δόση, η συγκέντρωση στο πλάσμα είναι δυνατό να εντοπισθεί μετά από 0,5-1 ώρα. Η Cmax επιτυγχάνεται μετά από 10-16 ώρες. Μετά την μέγιστη συγκέντρωση, οι συγκεντρώσεις στο πλάσμα παρουσιάζουν αργή μείωση για το υπόλοιπο των 24 ωρών μετά την εφαρμογή. Με πολλαπλές δόσεις (όπως στην σταθερή φάση), προτού το προηγούμενο διαδερμικό εμπλαστρο αντικατασταθεί με ένα καινούριο, οι συγκεντρώσεις στο πλάσμα αρχικά μειώνονται για περίπου 40 λεπτά κατά μέσο όρο, μέχρι η απορρόφηση από το καινούριο διαδερμικό έμπλαστρο γίνει πιο γρήγορη από την απέκκριση, και τα επίπεδα πλάσματος αρχίζουν να ανεβαίνουν ξανά, για να φτάσουν μια νέα μέγιστη συγκέντρωση στις περίπου 8 ώρες. Στην σταθερή φάση, τα επίπεδα ύφεσης είναι περίπου στο 50% των μέγιστων επιπέδων, σε αντίθεση με την από του στόματος χορήγηση, όπου οι συγκεντρώσεις πέφτουν σχεδόν στο μηδέν μεταξύ των δόσεων. Αν και λιγότερο εμφανές παρά στις από του στόματος μορφές, η έκθεση στην rivastigmine (Cmax και AUC) αυξανόταν υπέρ-αναλογικά κατά παράγοντα 2,6 και 4,9 στην μετάβαση από 4,6 mg/24 h σε 9,5 mg/24 h και 13,3 mg/24 h αντίστοιχα. Ο δείκτης διακύμανσης (FI), μια μέτρηση της σχετικής διαφοράς μεταξύ των συγκεντρώσεων αιχμής και συγκεντρώσεων ύφεσης ((Cmax-Cmin)/Cavg), ήταν 0,58 για τα Exelon διαδερμικά έμπλαστρα 4,6 mg/24 h, 0,77 για τα Exelon διαδερμικά έμπλαστρα 9,5 mg/24 h και 0,72 για τα Exelon διαδερμικά έμπλαστρα 13,3 mg/24 h, δείχνοντας έτσι μια πολύ μικρότερη διακύμανση μεταξύ των ελάχιστων και μέγιστων συγκεντρώσεων παρά για τις από του στόματος μορφές (FI = 3,96 (6 mg/ημέρα) και 4,15 (12 mg/ημέρα).
Η δοσολογία της rivastigmine που απελευθερώνεται από το διαδερμικό έμπλαστρο κατά την διάρκεια των 24 ωρών (mg/24 h) δεν μπορεί να εξισωθεί άμεσα με την ποσότητα (mg) της rivastigmine που περιέχεται σε μια κάψουλα σε σχέση με την συγκέντρωση στο πλάσμα ή οποία παράγεται κατά την διάρκεια των 24 ωρών.
Η μεταβλητότητα των φαρμακοκινητικών παραμέτρων της rivastigmine στον ίδιο το άτομο μετά από εφ'άπαξ δόση (ομαλοποιημένο ως προς δόση/kg βάρους σώματος) ήταν 43% (Cmax) και 49% (AUC0-24h) μετά την διαδερμική χορήγηση έναντι 74% και 103%, αντίστοιχα, μετά την από του στόματος μορφή. Η μεταβλητότητα στον ίδιο τον ασθενή κατά την σταθερή φάση της μελέτης στην άνοια Alzheimer υπήρξε μέχρι 45% (Cmax) και 43% (AUC0-24h) μετά την χρήση διαδερμικού εμπλάστρου, και 71% και 73%, αντίστοιχα, μετά την χορήγηση της από του στόματος μορφής.
Στους ασθενείς με άνοια Alzheimer παρατηρήθηκε σχέση μεταξύ της έκθεσης στο δραστικό συστατικό στην σταθερή φάση (rivastigmine και μεταβολίτης NAP226-90) και βάρους σώματος. Συγκριτικά με ένα ασθενή με βάρος σώματος 65 kg, οι συγκεντρώσεις της rivastigmine στην σταθερή φάση περίπου διπλασιάζονται σε σχέση με έναν ασθενή με βάρος σώματος 35 kg, ενώ για ένα ασθενή με βάρος σώματος 100 kg οι συγκεντρώσεις θα ήταν περίπου στο μισό. Το αποτέλεσμα του βάρους σώματος στην έκθεση στο δραστικό συστατικό υποδηλώνει ότι χρειάζεται ιδιαίτερη προσοχή σε ασθενείς με πολύ χαμηλό βάρος σώματος κατά την διαδικασία της αύξησης της δοσολογίας (βλ. παράγραφο 4.4).
Η έκθεση (AUC∞) στην rivastigmine (και τον μεταβολίτη NAP266-90) ήταν υψηλότερη όταν το διαδερμικό έμπλαστρο ετοποθετείτο στην άνω ράχη, θώρακα ή άνω βραχίονα και περίπου κατά 20-30% χαμηλότερη όταν ετοποθετείτο στην κοιλία ή τον μηρό.
Δεν υπήρξε σχετική συσσώρευση της rivastigmine ή του μεταβολίτη NAP226-90 στο πλάσμα, στους ασθενείς με την νόσο του Alzheimer, πέραν αυτών όπου τα επίπεδα πλάσματος ήταν ψηλότερα την δεύτερη μέρα της θεραπείας με διαδερμικό έμπλαστρο σε σχέση με την πρώτη.
Κατανομή
Η δέσμευση της rivastigmine στις πρωτεΐνες πλάσματος είναι χαμηλή (περίπου 40%). Διαπερνά εύκολα τον αιματεγκεφαλικό φραγμό και έχει φαινομενικό όγκο κατανομής μεταξύ 1,8 και 2,7 l/kg.
Βιομετασχηματισμός
Η rivastigmine μεταβολίζεται ταχέως και εκτενώς με εμφανή χρόνο ημισείας ζωής στο πλάσμα περίπου 3,4 ώρες μετά την αφαίρεση του διαδερμικού εμπλάστρου. Η απέκκριση περιοριζόταν από τον βαθμό απορρόφησης (κινητική flip-flop), το οποίο δικαιολογεί το μεγαλύτερο t/2 μετά το διαδερμικό έμπλαστρο (3,4 ώρες) έναντι των από του στόματος ή ενδοφλεβίων χορηγήσεων (1,4 εώς 1,7 ώρες). Ο μεταβολισμός γίνεται κυρίως μέσω υδρόλυσης με μεσολάβηση χολινεστεράσης, προς το μεταβολίτη NAP226-90. In vitro, ο μεταβολίτης αυτός αναστέλλει την ακετυλοχολινεστεράση σε περιορισμένο βαθμό (<10%).
Σύμφωνα με in vitro μελέτες, δεν αναμένεται καμία φαρμακοκινητική αλληλεπίδραση με φαρμακευτικά προϊοντα που μεταβολίζονται από τα ακόλουθα ισοένζυμα του κυτοχρώματος CYP1A2, CYP2D6, CYP3A4/5, CYP2E1, CYP2C9, CYP2C8, CYP2C19, ή CYP2B6. Σύμφωνα με ενδείξεις από μελέτες που έγιναν σε πειραματόζωα, τα μείζονα ισοένζυμα του κυτοχρώματος P450 ελάχιστα ενέχονται στο μεταβολισμό της rivastigmine. Η ολική κάθαρση της rivastigmine από το πλάσμα ήταν περίπου 130 l/ώρα μετά την ενδοφλέβια χορήγηση δόσης 0,2 mg, ενώ μειώθηκε σε 70 l/h μετά την ενδοφλέβια χορήγηση δόσης 2,7 mg, το οποίο συνάδει με με την μη-γραμμική, υπερ-αναλογική φαρμακοκινητική της rivastigmine λόγω κορεσμού στην απέκκριση της.
Η αναλογία AUC∞ μεταβολίτη-φαρμάκου ήταν περίπου 0,7 μετά την χορήγηση του διαδερμικού εμπλάστρου έναντι 3,5 μετά από του στόματος χορήγηση, καταδεικνύοντας έτσι πως πολύ λιγότερος μεταβολισμός πραγματοποιήθηκε στην διαδερμική παρά στην από του στόματος θεραπεία. Μετά την εφαρμογή του διαδερμικού εμπλάστρου σχηματίσθηκε λιγότερος NAP226-90 πιθανώς λόγω της έλλειψης προσυστεμικού (ηπατική πρώτη οδός) μεταβολισμού, σε αντίθεση με την από του στόματος χορήγηση.
Αποβολή
Στα ούρα ανευρίσκονται ίχνη αμετάβλητης rivastigmine; η νεφρική απέκκριση των μεταβολιτών είναι η βασική οδός απομάκρυνσής τους μετά την χορήγηση διαδερμικού εμπλάστρου. Ύστερα από τη χορήγηση rivastigmine ραδιοεπισημασμένης με 14C, η απέκκριση από τους νεφρούς ήταν ταχεία και ουσιαστικά πλήρης (>90%) εντός 24 ωρών. Ποσοστό χαμηλότερο από το 1% της χορηγούμενης δόσης απεκκρίνεται στα κόπρανα.
Μια φαρμακοκινητική ανάλυση του πληθυσμού έδειξε ότι η επακόλουθη χρήση νικοτίνης μετά από δοσή μέχρι και 12 mg/ημέρα rivastigmine από του στόματος καψάκια, αυξάνει την από του στόματος κάθαρση της rivastigmine κατά 23% στους ασθενείς με άνοια Alzheimer (n=75 καπνιστές και 549 μη-καπνιστές).
Ειδικοί πληθυσμοί
Ηλικιωμένοι
Η ηλικία δεν είχε επίδραση στην έκθεση στην rivastigmine σε ασθενείς με την νόσο του Alzheimer που έκαναν θεραπεία Exelon διαδερμικά έμπλαστρα.
Ηπατική δυσλειτουργία
Δεν πραγματοποιήθηκε καμία μελέτη με Exelon διαδερμικά έμπλαστρα σε άτομα με ηπατική δυσλειτουργία. Μετά από του στόματος χορήγηση, η Cmax της rivastigmine ήταν περίπου 60% υψηλότερη και η AUC της rivastigmine ήταν υπερδιπλάσια σε άτομα με ήπια έως μέτρια βεβαρημένη ηπατική λειτουργία από ότι σε υγιή άτομα.
Μετά από μια από τους στόματος εφ'άπαξ δόση 3 mg ή 6 mg, η μέση από του στόματος κάθαρση της rivastigmine ήταν περίπου 46-43% χαμηλότερη σε ασθενείς με ήπια έως μέτρια ηπατική δυσλειτουργία (n=10, βαθμολογία Child-Pugh 5-12, αποδεδειγμένο μέσω βιοψίας) από ότι σε υγιή άτομα.
Νεφρική δυσλειτουργία
Δεν πραγματοποιήθηκε καμία μελέτη με Exelon διαδερμικά έμπλαστρα σε άτομα με βεβαρημένη ηπατική λειτουργία. Με βάση την ανάλυση πληθυσμού, η κάθαρση της κρεατινίνης δεν κατέδειξε καθαρή επίδραση στις συγκεντρώσεις σταθερής κατάστασης της rivastigmine ή του μεταβολίτη της. Δεν απαιτείται προσαρμογή της δοσολογίας σε ασθενείς με νεφρική δυσλειτουργία.
Προκλινικά δεδομένα για την ασφάλεια
Μελέτες τοξικότητας από του στόματος και τοπικών επαναλαμβανόμενων δόσεων σε επίμυες, ποντικούς και σκύλους και χοιρίδια αποκάλυψαν μόνο επιδράσεις συνδεόμενες με υπερβολική φαρμακολογική δράση. Δεν παρατηρήθηκε καμία τοξική δράση στο όργανο-στόχο. Οι μελέτες από του στόματος και τοπικών δόσεων σε πειραματόζωα ήταν περιορισμένες, λόγω της ευαισθησίας των πειραματικών μοντέλων που χρησιμοποιήθηκαν.
Η rivastigmine δεν είχε μεταλλαξιογόνο δράση σε μια σειρά από τυπικές δοκιμασίες in vitro και in vivo, με μόνη εξαίρεση μία δοκιμασία χρωμοσωματικών εκτοπιών που έγινε σε ανθρώπινα περιφερικά λεμφοκύτταρα, σε δόση 104 φορές μεγαλύτερη από τη μέγιστη κλινική έκθεση. Η in vivo δοκιμασία μικροπυρήνων ήταν αρνητική. Ο κύριος μεταβολίτης NAP226-90 δεν παρουσίασε επίσης δυναμικό γονιδιοτοξικότητος.
Σε μελέτες με τοπική και από του στόματος χορήγηση που έγιναν σε επιμύες και σε μια μελέτη με από του στόματος χορήγηση σε ποντικούς δεν βρέθηκαν ενδείξεις καρκινογόνου δράσης με τη μέγιστη ανεκτή δόση. Η έκθεση στη rivastigmine και τους μεταβολίτες της ήταν περίπου ισοδύναμη με την έκθεση στον άνθρωπο σε υψηλότερες δοσολογίες rivastigmine με καψάκια και διαδερμικά έμπλαστρα.
Στα πειραματόζωα, η rivastigmine διαπερνά τον πλακούντα και απεκκρίνεται στο γάλα. Μελέτες με από του στόματος χορήγηση σε κυοφορούντες θηλυκούς επίμυες και κονίκλους δεν έδωσαν ενδείξεις πιθανής τερατογόνου δράσης της rivastigmine. Σε από του στόματος μελέτες με αρσενικούς και θηλυκούς επίμυες, δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες της rivastigmine στη γονιμότητα ή στην αναπαραγωγική απόδοση είτε στη μητρική γενεά είτε στους απογόνους της. Συγκεκριμένες δερματικές μελέτες σε κυοφορούντα θυληκά πειραματόζωα δεν έχουν γίνει.
Τα διαδερμικά έμπλαστρα rivastigmine δεν ήταν φωτοτοξικά και θεωρήθηκαν να είναι μη-ευαισθητοποιητικά. Σε κάποιες άλλες μελέτες δερματικής τοξικότητας, εμφανίσθηκε ένα ήπιο αποτέλεσμα ερεθισμού στο δέρμα των πειραματόζωων, συμπεριλαμβανομένων και αυτών του ελέγχου. Αυτό μπορεί να καταδεικνύει την πιθανότητα τα Exelon διαδερμικά έμπλαστρα να προκαλούν ήπιο ερύθημα στους ασθενείς.
Σε μια μελέτη με κονίκλους ταυτοποιήθηκε η δυνητικότητα ενός ήπιου ερεθισμού στα μάτια/βλεννογόνο της rivastigmine. Για το λόγο αυτό ο ασθενής/φροντιστής πρέπει να αποφεύγει την επαφή με τα μάτια μετά τον χειρισμό του εμπλάστρου (βλ. παράγραφο 4.4).
Καρκινογένεση, μεταλλάξεις, στείρωση
Γονιμότητα
Δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες στη γονιμότητα ή στην αναπαραγωγική απόδοση σε επίμυες (βλ. παράγραφο 5.3). Οι επιδράσεις της rivastigmine στην ανθρώπινη γονιμότητα δεν είναι γνωστές.
Ενεργά συστατικά
|
9IY2357JPE - RIVASTIGMINE TARTRATE
|
Σχετικό SPC
Exelon 4,6 mg/24 h διαδερμικό έμπλαστρο.
Exelon 9,5 mg/24 h διαδερμικό έμπλαστρο.
Exelon 13,3,6 mg/24 h διαδερμικό έμπλαστρο.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.
ΠΧΠ 2018: EXELON Διαδερμικό έμπλαστρο