Φαρμακοδυναμική
Φαρμακοθεραπευτική κατηγορία: Αναστολείς της HMG-CoA αναγωγάσης σε συνδυασμό με άλλους παράγοντες που τροποποιούν τα λιπίδια
Κωδικός ATC: C10BA02
To INEGY (εζετιμίμπη/σιμβαστατίνη) είναι ένα προϊόν που ελαττώνει τα λιπίδια, αναστέλλοντας επιλεκτικά την εντερική απορρόφηση της χοληστερόλης και συναφών φυτικών στερολών και αναστέλλοντας την ενδογενή σύνθεση της χοληστερόλης.
Μηχανισμός δράσης
INEGY
Η χοληστερόλη του πλάσματος προέρχεται από την εντερική απορρόφηση και την ενδογενή σύνθεση. Το INEGY περιέχει εζετιμίμπη και σιμβαστατίνη, δύο παράγοντες που ελαττώνουν τα λιπίδια με αλληλοσυμπληρούμενο μηχανισμό δράσης. Το INEGY μειώνει την αυξημένη ολική χοληστερόλη (ολική–C), την LDL–C, την απολιποπρωτεΐνη Β (Αpo B), τα τριγλυκερίδια (ΤG) και την χοληστερόλη με μη-υψηλής πυκνότητας λιποπρωτεΐνη (non HDL-C) και αυξάνει την χοληστερόλη με υψηλής πυκνότητας λιποπρωτεΐνη (HDL-C) μέσω διπλής αναστολής της απορρόφησης και σύνθεσης της χοληστερόλης.
Eζετιμίμπη
Η εζετιμίμπη αναστέλλει την εντερική απορρόφηση της χοληστερόλης. Η εζετιμίμπη χορηγούμενη από το στόμα είναι δραστική και έχει μηχανισμό δράσης που διαφέρει από άλλες κατηγορίες σκευασμάτων που μειώνουν τη χοληστερόλη (π.χ. στατίνες, ενώσεις που δεσμεύουν τα χολικά οξέα (ρητίνες), παράγωγα ινικού οξέος και φυτικές στανόλες). Ο μοριακός στόχος της εζετιμίμπης είναι ο μεταφορέας στερόλης, Niemann-Pick Cl-Like 1 (NPC1L1), που είναι υπεύθυνος για την εντερική απορρόφηση της χοληστερόλης και των φυτοστερολών.
Η εζετιμίμπη εντοπίζεται στις ψηκτροειδείς παρυφές του λεπτού εντέρου και αναστέλλει την απορρόφηση της χοληστερόλης, οδηγώντας σε μείωση της προσαγόμενης εντερικής χοληστερόλης στο ήπαρ. Οι στατίνες μειώνουν τη σύνθεση της χοληστερόλης στο ήπαρ και από κοινού, οι δύο αυτοί διαφορετικοί μηχανισμοί παρέχουν συμπληρωματικά μείωση της χοληστερόλης. Σε μία κλινική μελέτη δύο εβδομάδων σε 18 υπερχοληστερολαιμικούς ασθενείς, η εζετιμίμπη ανέστειλε την απορρόφηση της εντερικής χοληστερόλης κατά 54% σε σύγκριση με το placebo.
Διεξήχθη μία σειρά προκλινικών μελετών για να προσδιορισθεί η εκλεκτικότητα της εζετιμίμπης στην αναστολή της απορρόφησης της χοληστερόλης. Η εζετιμίμπη ανέστειλε την απορρόφηση της [14C] χοληστερόλης χωρίς καθόλου επίδραση στην απορρόφηση των τριγλυκεριδίων, λιπαρών οξέων, χολικών οξέων, προγεστερόνης, αιθυνυλοιστραδιόλης ή των λιποδιαλυτών βιταμινών Α και D.
Σιμβαστατίνη
Μετά τη χορήγηση από το στόμα, η σιμβαστατίνη, η οποία είναι μία αδρανής λακτόνη, υδρολύεται στο ήπαρ στην αντίστοιχη ενεργό μορφή β-υδροξυοξύ, που έχει ισχυρή δραστικότητα στην αναστολή της HMG-CoA αναγωγάσης (3 υδροξυ-3 μεθυλογλουταρυλο CoA αναγωγάση). Αυτό το ένζυμο καταλύει την μετατροπή της HMG-CoA σε μεβαλονικό, ένα πρώιμο και περιοριστικό του ρυθμού στάδιο στη βιοσύνθεση της χοληστερόλης.
Η σιμβαστατίνη έχει δείξει ότι μειώνει τις φυσιολογικές αλλά και τις αυξημένες συγκεντρώσεις της LDL-χοληστερόλης. H LDL C σχηματίζεται από πολύ χαμηλής πυκνότητας λιποπρωτεΐνη (VLDL) και καταβολίζεται κυρίως από τον υψηλής συγγένειας LDL υποδοχέα. Ο μηχανισμός με τον οποίο επιτυγχάνεται μείωση της LDL με τη σιμβαστατίνη, μπορεί να περιλαμβάνει και τη μείωση των συγκεντρώσεων της VLDL χοληστερόλης (VLDL-C) και την επαγωγή του LDL υποδοχέα, οδηγώντας σε μειωμένη παραγωγή και αυξημένο καταβολισμό της LDL χοληστερόλης. Η αποπολιπρωτεΐνη Β επίσης μειώνεται ουσιαστικά κατά τη διάρκεια της θεραπείας με σιμβαστατίνη. Επιπρόσθετα, η σιμβαστατίνη αυξάνει μέτρια την HDL χοληστερόλη και μειώνει τα τριγλυκερίδια του πλάσματος. Ως αποτέλεσμα αυτών των αλλαγών ο λόγος της ολικής χοληστερόλης προς την HDL-χοληστερόλη και της LDL- προς την HDL-χοληστερόλη μειώνεται.
Κλινική αποτελεσματικότητα και ασφάλεια
Σε ελεγχόμενες κλινικές μελέτες, το INEGY μείωσε σημαντικά την ολική C, LDL-C, ApoB, τα τριγλυκερίδια (ΤG) και τη μη HDL-C και αύξησε την ΗDL-C σε ασθενείς με υπερχοληστερολαιμία.
Πρόληψη των Καρδιαγγειακών Επεισοδίων
Το INEGY έχει αποδειχθεί ότι μειώνει τα μείζονα καρδιαγγειακά επεισόδια σε ασθενείς με στεφανιαία νόσο και με ιστορικό επεισοδίου Οξέος Στεφανιαίου Συνδρόμου (ΟΣΣ).
Η IMPROVE-IT (IMProved Reduction of Outcomes: Vytorin Efficacy International Trial), ήταν μία πολυκεντρική, τυχαιοποιημένη, διπλά-τυφλή, ελεγχόμενη με ενεργό παράγοντα μελέτη με 18.144 ασθενείς, οι οποίοι εντάχθηκαν εντός 10 ημερών από την εισαγωγή τους σε νοσοκομείο για οξύ στεφανιαίο σύνδρομο (ΟΣΣ, είτε οξύ έμφραγμα του μυοκαρδίου [ΟΕΜ], είτε ασταθής στηθάγχη [ΑΣ]). Οι ασθενείς είχαν LDL-C ≤125 mg/dl (≤3,2 mmol/l) κατά την εκδήλωση του Οξέος Στεφανιαίου Συνδρόμου (ΟΣΣ) εάν δεν λάμβαναν υπολιπιδαιμική θεραπεία ή ≤ 100 mg/dl (≤ 2,6 mmol/l) εάν λάμβαναν υπολιπιδαιμική θεραπεία. Όλοι οι ασθενείς τυχαιοποιήθηκαν σε μια αναλογία 1:1 να λάβουν είτε εζετιμίμπη/σιμβαστατίνη 10/40 mg (n=9.067) είτε σιμβαστατίνη 40 mg (n=9.077) και με διάμεση περίοδο παρακολούθησης 6,0 χρόνων.
Οι ασθενείς είχαν μέση ηλικία 63,6 έτη, το 76% ήταν άνδρες, το 84% ήταν Καυκάσιοι και το 27% ήταν διαβητικοί. Η μέση τιμή της LDL-C κατά τη χρονική στιγμή του συμβάντος ένταξης στη μελέτη ήταν 80 mg/dl (2,1 mmol/l) για εκείνους που λάμβαναν υπολιπιδαιμική θεραπεία (n=6.390) και 101 mg/dl (2,6 mmol/l) για εκείνους που δεν είχαν λάβει προηγούμενη υπολιπιδαιμική θεραπεία (n=11.594). Πριν την εισαγωγή στο νοσοκομείο λόγω επεισοδίου οξέος στεφανιαίου συνδρόμου (ΟΣΣ), το 34% των ασθενών λάμβαναν θεραπεία με στατίνη. Στον ένα χρόνο, η μέση LDL-C σε ασθενείς που συνέχισαν τη θεραπεία ήταν 53,2 mg/dl (1,4 mmol/l) για την ομάδα του INEGY και 69,9 mg/dl (1,8 mmol/l) για την ομάδα που έλαβε μονοθεραπεία με σιμβαστατίνη. Τιμές λιπιδίων ελήφθησαν γενικά σε ασθενείς που παρέμειναν στη θεραπεία της μελέτης.
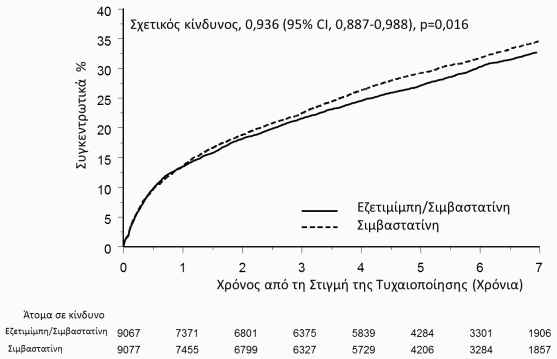
Το κύριο καταληκτικό σημείο ήταν η σύνθεση θανάτου καρδιαγγειακής αιτιολογίας, μειζόνων στεφανιαίων συμβαμάτων (ΜΣΣ, που ορίζονται ως μη θανατηφόρο έμφραγμα του μυοκαρδίου, τεκμηριωμένη ασταθής στηθάγχη που χρειάστηκε εισαγωγή σε νοσοκομείο ή οποιαδήποτε επέμβαση στεφανιαίας επαναγγείωσης που πραγματοποιήθηκε τουλάχιστον 30 ημέρες μετά την τυχαιοποιημένη ανάθεση θεραπείας) και μη θανατηφόρου εγκεφαλικού επεισοδίου. Η μελέτη έδειξε ότι η θεραπεία με INEGY παρείχε επιπρόσθετο όφελος στη μείωση του κύριου σύνθετου καταληκτικού σημείου του θανάτου καρδιαγγειακής αιτιολογίας, των μειζόνων στεφανιαίων συμβαμάτων (ΜΣΣ) και του μη θανατηφόρου εγκεφαλικού επεισοδίου σε σύγκριση με τη μονοθεραπεία με σιμβαστατίνη (μείωση σχετικού κινδύνου κατά 6,4%, p=0,016). To κύριο καταληκτικό σημείο συνέβη στους 2.572 από τους 9.067 ασθενείς (ποσοστό Kaplan-Meier [KM] 7-χρόνων 32,72%) στην ομάδα του INEGY και στους 2.742 από τους 9.077 ασθενείς (ποσοστό ΚΜ 7-χρόνων 34,67%) στην ομάδα της μονοθεραπείας με σιμβαστατίνη. (Βλέπε Σχήμα 1 και Πίνακα 2.) Η συνολική θνησιμότητα ήταν αμετάβλητη σε αυτή την ομάδα υψηλού κινδύνου (Βλέπε Πίνακα 2).
Υπήρξε ένα συνολικό όφελος σε όλα τα εγκεφαλικά επεισόδια. Ωστόσο, υπήρξε μια μικρή μη σημαντική αύξηση στο αιμορραγικό αγγειακό εγκεφαλικό επεισόδιο στην ομάδα της εζετιμίμπης-σιμβαστατίνης σε σύγκριση με τη μονοθεραπεία με σιμβαστατίνη (βλέπε Πίνακα 2). Ο κίνδυνος αιμορραγικού αγγειακού εγκεφαλικού επεισοδίου από τη συγχορήγηση εζετιμίμπης με ισχυρότερες στατίνες σε μακροχρόνιες μελέτες έκβασης δεν έχει αξιολογηθεί.
Τα αποτελέσματα της αγωγής με εζετιμίμπη/σιμβαστατίνη σε πολλές υποομάδες ασθενών συμπεριλαμβανομένου φύλου, ηλικίας, φυλής, ιατρικού ιστορικού σακχαρώδους διαβήτη, επιπέδων λιπιδίων κατά την ένταξη στη μελέτη, προηγούμενης θεραπείας με στατίνη, προηγούμενου εγκεφαλικού επεισοδίου και υπέρτασης, ήταν γενικά σε συμφωνία με τα συνολικά αποτελέσματα της μελέτης.
Σχήμα 1. Επίδραση του INEGY στο Κύριο Σύνθετο Καταληκτικό Σημείο του Θανάτου Καρδιαγγειακής Αιτιολογίας, του Μείζονος Στεφανιαίου Συμβάματος ή του Μη θανατηφόρου Εγκεφαλικού Επεισοδίου:
Πίνακας 2. Μείζονα Καρδιαγγειακά Συμβάματα ανά Ομάδα Θεραπείας σε Όλους τους Ασθενείς που Τυχαιοποιήθηκαν στην IMPROVE-IT:
| Έκβαση | INEGY 10/40 mga (n=9.067) | Σιμβαστατίνη 40 mgb (n=9.077) | Σχετικός Κίνδυνος (95% CI) | τιμή-p | ||
|---|---|---|---|---|---|---|
| n | K-M%c | n | K-M%c | |||
| Κύριο Σύνθετο Καταληκτικό Σημείο Αποτελεσματικότητας | ||||||
| (Θάνατος καρδιαγγειακής αιτιολογίας, Μείζονα Στεφανιαία Συμβάματα και μη θανατηφόρο εγκεφαλικό επεισόδιο) | 2.572 | 32,72% | 2.742 | 34,67% | 0,936 (0,887, 0,988) | 0,016 |
| Δευτερεύοντα Σύνθετα Καταληκτικά Σημεία Αποτελεσματικότητας | ||||||
| Θάνατος από Στεφανιαία Νόσο, μη θανατηφόρο Έμφραγμα του Μυοκαρδίου, επείγουσα στεφανιαία επαναγγείωση μετά από 30 ημέρες | 1.322 | 17,52% | 1.448 | 18,88% | 0,912 (0,847, 0,983) | 0,016 |
| Μείζονα Στεφανιαία Συμβάματα (ΜΣΣ), μη θανατηφόρο εγκεφαλικό επεισόδιο, θάνατος (όλες οι αιτιολογίες) | 3.089 | 38,65% | 3.246 | 40,25% | 0,948 (0,903, 0,996) | 0,035 |
| Θάνατος καρδιαγγειακής αιτιολογίας, μη θανατηφόρο Έμφραγμα του Μυοκαρδίου, ασταθής στηθάγχη που απαιτεί εισαγωγή σε νοσοκομείο, οποιαδήποτε επαναγγείωση, μη θανατηφόρο εγκεφαλικό επεισόδιο | 2.716 | 34,49% | 2.869 | 36,20% | 0,945 (0,897, 0,996) | 0,035 |
| Στοιχεία Κύριου Σύνθετου Καταληκτικού Σημείου και Επιλεγμένα Καταληκτικά Σημεία Αποτελεσματικότητας (πρώτη εμφάνιση συγκεκριμένου συμβάματος οποιαδήποτε χρονική στιγμή) | ||||||
| Θάνατος καρδιαγγειακής αιτιολογίας | 537 | 6,89% | 538 | 6,84% | 1,000 (0,887, 1,127) | 0,997 |
| Μείζον Στεφανιαίο Συμβάν: | ||||||
| Μη θανατηφόρο Έμφραγμα Μυοκαρδίου | 945 | 12,77% | 1083 | 14,41% | 0,871 (0,798, 0,950) | 0,002 |
| Ασταθής στηθάγχη που απαιτεί εισαγωγή σε νοσοκομείο | 156 | 2,06% | 148 | 1,92% | 1,059 (0,846, 1,326) | 0,618 |
| Στεφανιαία επαναγγείωση μετά από 30 ημέρες | 1.690 | 21,84% | 1.793 | 23,36% | 0,947 (0,886, 1,012) | 0,107 |
| Μη θανατηφόρο εγκεφαλικό επεισόδιο | 245 | 3,49% | 305 | 4,24% | 0,802 (0,678, 0,949) | 0,010 |
| Όλα τα Εμφράγματα Μυοκαρδίου (θανατηφόρα και μη θανατηφόρα) | 977 | 13,13% | 1.118 | 14,82% | 0,872 (0,800, 0,950) | 0,002 |
| Όλα τα εγκεφαλικά επεισόδια (θανατηφόρα και μη θανατηφόρα) | 296 | 4,16% | 345 | 4,77% | 0,857 (0,734, 1,001) | 0,052 |
| Μη αιμορραγικό αγγειακό εγκεφαλικό επεισόδιοd | 242 | 3,48% | 305 | 4,23% | 0,793 (0,670, 0,939) | 0,007 |
| Αιμορραγικό αγγειακό εγκεφαλικό επεισόδιο | 59 | 0,77% | 43 | 0,59% | 1,377 (0,930, 2,040) | 0,110 |
| Θάνατος από οποιαδήποτε αιτιολογία | 1.215 | 15,36% | 1.231 | 15,28% | 0,989 (0,914, 1,070) | 0,782 |
a Στο 6% έγινε τιτλοποίηση προς τα πάνω σε εζετιμίμπη/σιμβαστατίνη 10/80 mg.
b Στo 27% έγινε τιτλοποίηση προς τα πάνω σε σιμβαστατίνη 80 mg.
c Εκτίμηση Kaplan-Meier στα 7 χρόνια.
d περιλαμβάνει ισχαιμικό αγγειακό εγκεφαλικό επεισόδιο ή εγκεφαλικό επεισόδιο μη προσδιορισμένου τύπου.
Πρωτοπαθής Υπερχοληστερολαιμία
Σε μία διπλά-τυφλή, ελεγχόμενη με placebo μελέτη διάρκειας 8 εβδομάδων, 240 ασθενείς με υπερχοληστερολαιμία που ήδη ελάμβαναν μονοθεραπεία με σιμβαστατίνη και δεν είχαν επιτύχει το στόχο στην μείωση της LDL (2,6 ως 4,1 mmol/l [100 ως 160 mg/dl], ανάλογα με τα αρχικά χαρακτηριστικά), σύμφωνα με το πρόγραμμα Νational Cholesterol Education Program (NCEP), τυχαιοποιήθηκαν να λάβουν είτε εζετιμίμπη 10 mg ή placebo επιπροσθέτως στην υπάρχουσα θεραπεία με σιμβαστατίνη. Μεταξύ των ασθενών που έλαβαν θεραπεία με σιμβαστατίνη και που δεν βρίσκονταν στο στόχο LDL-C στην έναρξη της μελέτης (~80%), σημαντικά περισσότεροι ασθενείς που τυχαιοποιήθηκαν σε εζετιμίμπη συγχορηγούμενη με σιμβαστατίνη πέτυχαν τον στόχο LDL-C στο τέλος της μελέτης σε σύγκριση με ασθενείς που τυχαιοποιήθηκαν σε placebo συγχορηγούμενο με σιμβαστατίνη, 76% και 21,5%, αντιστοίχως.
Οι αντίστοιχες μειώσεις LDL-C για την εζετιμίμπη ή placebo που συγχορηγήθηκε με σιμβαστατίνη ήταν επίσης σημαντικά διαφορετικές (27% ή 3% αντιστοίχως). Επιπλέον, η εζετιμίμπη που συγχορηγήθηκε με σιμβαστατίνη μείωσε σημαντικά την ολική C, την Apo B και τα τριγλυκερίδια (ΤG), σε σύγκριση με το placebo που συγχορηγήθηκε με σιμβαστατίνη.
Σε μία πολυκεντρική, διπλά –τυφλή μελέτη, διάρκειας 24 εβδομάδων, 214 ασθενείς με τύπου 2 σακχαρώδη διαβήτη που έλαβαν θεραπεία με θειαζολιδινεδιόνες (ροσιγλιταζόνη ή πιογλιταζόνη) για τουλάχιστον 3 μήνες και σιμβαστατίνη 20 mg τουλάχιστον για 6 εβδομάδες, με μέση τιμή LDL-C 2,4 mmol/L (93 mg/dl), τυχαιοποιήθηκαν να λάβουν είτε σιμβαστατίνη 40 mg ή τα συγχορηγούμενα δραστικά συστατικά ισοδύναμα με INEGY 10mg/20mg. Το INEGY 10mg/20mg ήταν σημαντικά περισσότερο αποτελεσματικό από την διπλάσια δόση σιμβαστατίνης ως 40 mg στην περαιτέρω μείωση της LDL-C (-21% και 0% αντιστοίχως), της ολικής–C (-14% και - 1% αντιστοίχως), της Apo B (-14% και 2% αντιστοίχως),και της χοληστερόλης μηυψηλής πυκνότητας λιποπρωτεΐνης (non HDL-C) (-20% και -2% αντιστοίχως), πέρα από τη μείωση που παρατηρήθηκε με σιμβαστατίνη 20 mg. Τα αποτελέσματα για την HDL-C και TG μεταξύ των δύο ομάδων θεραπείας δεν διέφεραν σημαντικά. Τα αποτελέσματα δεν είχαν επηρεασθεί από το είδος της θεραπείας με θειαζολιδινεδιόνη.
Η αποτελεσματικότητα των διαφορετικών δοσολογικών περιεκτικοτήτων του INEGY (10/10 ως 10/80 mg ημερησίως) έχει αποδειχθεί σε μία πολυκεντρική, διπλά - τυφλή, ελεγχόμενη με placebo μελέτη διάρκειας 12 εβδομάδων, που συμπεριέλαβε όλες τις διαθέσιμες δόσεις του INEGY και όλες τις σχετιζόμενες δόσεις σιμβαστατίνης. Όταν συγκρίθηκαν οι ασθενείς που έλαβαν όλες τις δόσεις του INEGY με τους ασθενείς που έλαβαν όλες τις δόσεις σιμβαστατίνης, το INEGY μείωσε σημαντικά την ολική C, την LDL-C και τα TG (βλέπε Πίνακα 1) καθώς και την Apo B (-42% και -29% αντιστοίχως), τη μη-HDL-C (-49% και 34% αντιστοίχως) και Cαντιδρώσα πρωτεΐνη (-33% και -9% αντιστοίχως). Οι επιδράσεις του INEGY στην HDL-C ήταν παρόμοιες με τις επιδράσεις που παρουσιάσθηκαν με τη σιμβαστατίνη. Περαιτέρω ανάλυση έδειξε ότι το INEGY αύξησε σημαντικά την HDL-C σε σύγκριση με το placebo.
Πίνακας 3. Ανταπόκριση στο INEGY σε ασθενείς με Πρωτοπαθή Υπερχοληστερολαιμία (Μέσηα% Μεταβολή από την αρχική τιμή χωρίς θεραπείαβ):
| Θεραπεία (Ημερήσια δοσολογία) | Ν | Ολική-C | LDL-C | HDL-C | TGα |
|---|---|---|---|---|---|
| Συγκεντρωτικά στοιχεία (Όλες οι δοσολογίες του INEGY)γ | 353 | -38 | -53 | +8 | -28 |
| Συγκεντρωτικά στοιχεία οι δοσολογίες της σιμβαστατίνης)γ | 349 | -26 | -38 | +8 | -15 |
| Εζετιμίμπη 10 mg | 92 | -14 | -20 | +7 | -13 |
| Placebo | 93 | +2 | +3 | +2 | -2 |
| INEGY ανά δοσολογία | |||||
| 10/10 | 87 | -32 | -46 | +9 | -21 |
| 10/20 | 86 | -37 | -51 | +8 | -31 |
| 10/40 | 89 | -39 | -55 | +9 | -32 |
| 10/80 | 91 | -43 | -61 | +6 | -28 |
| Σιμβαστατίνη ανά δοσολογία | |||||
| 10 mg | 81 | -21 | -31 | +5 | -4 |
| 20 mg | 90 | -24 | -35 | +6 | -14 |
| 40 mg | 91 | -29 | -42 | +8 | -19 |
| 80 mg | 87 | -32 | -46 | +11 | -26 |
α Για τριγλυκερίδια, μέση% μεταβολή από την αρχική τιμή
β Αρχική τιμή - χωρίς κανένα φάρμακο που μειώνει τα λιπίδια
γ Οι συγκεντρωτικές δόσεις INEGY (10/10-10/80), μείωσαν σημαντικά την ολική-C, LDL-C, και TG, σε σύγκριση με τη σιμβαστατίνη και αύξησαν σημαντικά την HDL-C σε σύγκριση με το placebo.
Σε μία παρόμοια σχεδιασμένη μελέτη, τα αποτελέσματα για όλες τις παραμέτρους λιπιδίων ήταν γενικά παρόμοια. Σε μία συγκεντρωτική ανάλυση αυτών των δύο κλινικών μελετών, η ανταπόκριση των λιπιδίων στο INEGY ήταν παρόμοια σε ασθενείς με επίπεδα τριγλυκεριδίων μεγαλύτερα από ή μικρότερα από 200 mg/dl.
Σε μία πολυκεντρική, διπλά-τυφλή, ελεγχόμενη κλινική μελέτη (ENHANCE), 720 ασθενείς με ετερόζυγο οικογενή υπερχοληστερολαιμία τυχαιοποιήθηκαν να λάβουν εζετιμίμπη 10 mg σε συνδυασμό με σιμβαστατίνη 80 mg (n=357) ή σιμβαστατίνη 80 mg (n=363) για 2 χρόνια. Ο πρωταρχικός σκοπός της μελέτης ήταν να ερευνήσει την επίδραση της θεραπείας συνδυασμού εζετιμίμπη/σιμβαστατίνη στο πάχος του έσω-μέσω χιτώνα της καρωτιδικής αρτηρίας (ΙΜΤ) σε σύγκριση με την μονοθεραπεία με σιμβαστατίνη. Η επίδραση αυτού του ενδιάμεσου δείκτη στην καρδιακή νοσηρότητα και θνησιμότητα δεν έχει ακόμα δειχθεί.
Το πρωταρχικό τελικό σημείο της μελέτης, η αλλαγή στη μέση ΙΜΤ και των έξι τμημάτων της καρωτίδας, δεν διέφερε σημαντικά (p=0,29) μεταξύ των δύο ομάδων θεραπείας όπως μετρήθηκε από υπέρηχο B-mode. Η εζετιμίμπη 10 mg σε συνδυασμό με σιμβαστατίνη 80 mg ή η σιμβαστατίνη 80 mg μόνη της περιόρισαν το πάχος του έσω-μέσω χιτώνα καρωτίδας κατά 0,0111 mm και 0,0058 mm αντίστοιχα, καθ' όλη τη 2 ετή διάρκεια της μελέτης (αρχική μέση τιμή ΙΜΤ 0,68 mm και 0,69 mm αντιστοίχως).
Η εζετιμίμπη 10 mg σε συνδυασμό με σιμβαστατίνη 80 mg μείωσε σημαντικά περισσότερο τις LDLC, ολική-C, Apo B, και TG, σε σχέση με τη σιμβαστατίνη 80 mg. Η εκατοστιαία αύξηση της HDL-C ήταν όμοια και στις δύο θεραπευτικές ομάδες. Οι ανεπιθύμητες ενέργειες που αναφέρθηκαν για την εζετιμίμπη 10 mg σε συνδυασμό με σιμβαστατίνη 80 mg ήταν σύμφωνα με το γνωστό προφίλ ασφάλειας τους.
Το INEGY περιέχει σιμβαστατίνη. Σε δύο μεγάλες ελεγχόμενες με placebo κλινικές μελέτες, τη Σκανδιναβική Μελέτη Επιβίωσης της Σιμβαστατίνης (20-40 mg, n=4.444 ασθενείς) και τη Μελέτη Καρδιακής Προστασίας (40 mg, n=20.536 ασθενείς), αξιολογήθηκαν οι επιδράσεις της θεραπείας με σιμβαστατίνη σε ασθενείς με μεγάλο κίνδυνο στεφανιαίου επεισοδίου λόγω υπάρχουσας στεφανιαίας καρδιακής νόσου, διαβήτη, περιφερικής αγγειακής νόσου, ιστορικού εγκεφαλικού επεισοδίου ή άλλης αγγειοεγκεφαλικής νόσου. Η σιμβαστατίνη έχει αποδείξει ότι μειώνει: τον κίνδυνο της ολικής θνησιμότητας μειώνοντας τους θανάτους από στεφανιαία καρδιακή νόσο (CHD), τον κίνδυνο μη θανατηφόρων εμφραγμάτων του μυοκαρδίου και εγκεφαλικών επεισοδίων και την ανάγκη εφαρμογής επεμβάσεων στεφανιαίας και μη στεφανιαίας επαναγγείωσης.
Κατά την Μελέτη Αποτελεσματικότητας Επιπλέον Μειώσεων της Χοληστερόλης και Ομοκυστεΐνης (SEARCH) αξιολογήθηκε το αποτέλεσμα της θεραπείας με σιμβαστατίνη 80 mg έναντι 20 mg (διάμεσος χρόνος παρακολούθησης 6,7 χρόνια) σχετικά με αγγειακά επεισόδια μείζονος σημασίας (ΑΕΜΣ, ορίζεται ως θανατηφόρα ΣΚΝ, μη-θανατηφόρα ΕΜ, διαδικασία στεφανιαίας επαναγγείωσης, μη-θανατηφόρο ή θανατηφόρο εγκεφαλικό επεισόδιο, ή διαδικασία περιφερικής επαναγγείωσης) σε 12.064 ασθενείς με ιστορικό εμφράγματος μυοκαρδίου. Δεν υπήρξε σημαντική διαφορά στη συχνότητα των ΑΕΜΣ μεταξύ των 2 ομάδων, σιμβαστατίνη 20 mg (n=1.553 25,7%) έναντι σιμβαστατίνης 80 mg (n=1.477, 24,5%); RR 0,94, 95% CI: 0,88 έως 1,01. Η απόλυτη διαφορά σχετικά με την LDL-C μεταξύ των δύο ομάδων κατά την διάρκεια της μελέτης ήταν 0,35 ± 0,01 mmol/L. Τα προφίλ ασφάλειας ήταν παρόμοια μεταξύ των 2 ομάδων θεραπείας εκτός του ότι η συχνότητα μυοπάθειας ήταν περίπου 1,0% σε ασθενείς που έλαβαν θεραπεία με σιμβαστατίνη 80 mg σε σύγκριση με 0,02% σε ασθενείς που έλαβαν θεραπεία με σιμβαστατίνη 20 mg. Περίπου το ήμισυ αυτών των περιστατικών μυοπάθειας παρουσιάσθηκε κατά τον πρώτο χρόνο θεραπείας. Η συχνότητα μυοπάθειας κατά την διάρκεια κάθε επόμενου χρόνου θεραπείας ήταν περίπου 0,1%.
Παιδιατρικός πληθυσμός
Σε μια πολυκεντρική διπλά-τυφλή, ελεγχόμενη μελέτη, 142 αγόρια (σταδίου ΙΙ Tanner και άνω) και 106 κορίτσια μετά την εμμηναρχή, ηλικίας 10 έως 17 ετών (μέσος όρος ηλικίας 14,2 χρόνια) με ετερόζυγο οικογενή υπερχοληστερολαιμία (HeFH) με αρχικά επίπεδα τιμής της LDL-C μεταξύ 4,1 και 10,4 mmol/l τυχαιοποιήθηκαν να λάβουν είτε εζετιμίμπη 10 mg συγχορηγούμενη με σιμβαστατίνη (10, 20 ή 40 mg) ή μόνο σιμβαστατίνη (10, 20 ή 40 mg) για 6 εβδομάδες, εζετιμίμπη συγχορηγούμενη με 40 mg σιμβαστατίνης ή 40 mg σιμβαστατίνης μόνο για επιπλέον 27 εβδομάδες και στη συνέχεια σε ανοικτή μελέτη συγχορηγούμενη εζετιμίμπη και σιμβαστατίνη (10 mg, 20 mg ή 40 mg) για 20 εβδομάδες.
Την εβδομάδα 6, η εζετιμίμπη συγχορηγούμενη με σιμβαστατίνη (σε όλες τις δόσεις) μείωσε σημαντικά την ολική C (38% vs 26%), την LDL-C (49% vs 34%), την Apo B (39% vs 27%) και την μη-HDL-C (47% vs 33%) συγκριτικά με την χορήγηση μόνον σιμβαστατίνης (σε όλες τις δόσεις). Τα αποτελέσματα για τις δύο ομάδες θεραπείας ήταν παρόμοια για τα τριγλυκερίδια (TG) και την HDL-C (-17% vs -12% και +7% vs +6%, αντίστοιχα). Την εβδομάδα 33, τα αποτελέσματα ήταν σύμφωνα με εκείνα της εβδομάδας 6 και σημαντικά περισσότεροι ασθενείς που λάμβαναν εζετιμίμπη και 40 mg σιμβαστατίνης (62%) είχαν επιτύχει τον ιδανικό στόχο σύμφωνα με το πρόγραμμα Νational Cholesterol Education Program (NCEP) APP (<2,8 mmol/L[110 mg/dl]) σε σύγκριση με την LDL-C σε όσους έλαβαν 40 mg σιμβαστατίνης (25%). Την εβδομάδα 53, κατά το τέλος της παράτασης της ανοιχτής μελέτης, οι επιδράσεις στις παραμέτρους των λιπιδίων διατηρήθηκαν.
Η ασφάλεια και η αποτελεσματικότητα της εζετιμίμπης συγχορηγούμενης με δόσεις σιμβαστατίνης πάνω από 40 mg ημερησίως δεν έχει μελετηθεί σε παιδιατρικούς ασθενείς ηλικίας 10 έως 17 ετών. Δεν έχει μελετηθεί η μακροχρόνια αποτελεσματικότητα της θεραπείας με εζετιμίμπη σε ασθενείς ηλικίας κάτω των 17 ετών για την μείωση της νοσηρότητας και της θνησιμότητας κατά την ενηλικίωση.
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων έχει δώσει απαλλαγή από την υποχρέωση υποβολής των αποτελεσμάτων των μελετών με INEGY σε όλες τις υποκατηγορίες του παιδιατρικού πληθυσμού στην Υπερχοληστερολαιμία (βλέπε παράγραφο 4.2 για πληροφορίες σχετικά με την παιδιατρική χρήση).
Ομόζυγος Οικογενής Υπερχοληστερολαιμία (ΗoFH)
Μία διπλά-τυφλή, τυχαιοποιημένη μελέτη, διάρκειας 12 εβδομάδων διεξήχθη σε ασθενείς με κλινική και/ή γονοτυπική διάγνωση της ομόζυγης οικογενούς υπερχοληστερολαιμίας (HoFH). Αναλύθηκαν τα στοιχεία μίας υποομάδας ασθενών (n=14), που ελάμβαναν σιμβαστατίνη 40mg κατά την έναρξη. Αύξηση της δόσης της σιμβαστατίνης από 40 σε 80 mg (n=5), προκάλεσε μείωση της LDL-C κατά 13% σε σχέση με την αρχική τιμή με σιμβαστατίνη 40mg. Η συγχορήγηση της εζετιμίμπης και της σιμβαστατίνης ισοδύναμο με το INEGY (10mg/40mg και 10mg/80mg συγκεντρωτικά, n=9), προκάλεσε μείωση της LDL-C κατά 23% σε σχέση με την αρχική τιμή με σιμβαστατίνη 40mg. Σ' αυτούς τους ασθενείς που συγχορηγήθηκε εζετιμίμπη και σιμβαστατίνη ισοδύναμο με INEGY (10mg/80mg, n=5), παρουσιάσθηκε μείωση της LDL-C κατά 29% σε σχέση με την αρχική τιμή με σιμβαστατίνη 40 mg.
Πρόληψη των Μειζόνων Αγγειακών Συμβαμάτων στην Χρόνια Νεφρική Νόσο (ΧΝΝ)
Η μελέτη Καρδιακής και Νεφρικής Προστασίας (SHARP) ήταν μια πολυεθνική, τυχαιοποιημένη, ελεγχόμενη με εικονικό φάρμακο, διπλά-τυφλή μελέτη που διεξήχθη σε 9.438 ασθενείς με χρόνια νεφρική νόσο, το ένα τρίτο των οποίων υποβάλλονταν σε αιμοκάθαρση κατά την έναρξη. Συνολικά 4.650 ασθενείς ορίσθηκε να λάβουν INEGY 10/20 mg και 4620 ασθενείς εικονικό φάρμακο με ένα διάμεσο διάστημα παρακολούθησης 4,9 χρόνων. Οι ασθενείς είχαν έναν μέσο όρο ηλικίας 62 ετών και το 63% ήταν άνδρες, το 72% Καυκάσιοι, το 23% διαβητικοί και για όσους δεν υποβάλλονταν σε αιμοκάθαρση ο μέσος εκτιμώμενος ρυθμός σπειραματικής διήθησης (eGFR) ήταν 26,5 ml/min/1,73 m². Δεν υπήρξαν κριτήρια ένταξης στην μελέτη όσον αφορά τα λιπίδια. Η μέση LDL-C κατά την έναρξη ήταν 108 mg/dl. Μετά από έναν χρόνο, η LDL-C μειώθηκε στο 26% σε σχέση με το εικονικό φάρμακο με σιμβαστατίνη 20 mg και 38% με INEGY 10/20mg συμπεριλαμβανομένων των ασθενών που δεν λάμβαναν πια την φαρμακευτική αγωγή της μελέτης.
Η καθορισμένη από το πρωτόκολλο της μελέτης SHARP πρωταρχική σύγκριση ήταν μια ανάλυση πρόθεσης-για-θεραπεία των “μειζόνων αγγειακών συμβαμάτων” (MVE, ορίζεται ως μη θανατηφόρο έμφραγμα του μυοκαρδίου ή καρδιακός θάνατος, εγκεφαλικό επεισόδιο ή οποιαδήποτε επέμβαση επαναγγείωσης) μόνον σε εκείνους τους ασθενείς που αρχικά τυχαιοποιήθηκαν στις ομάδες INEGY (n=4193) ή εικονικού φαρμάκου (n=4191). Δευτερεύουσες αναλύσεις συμπεριέλαβαν την ίδια σύνθεση που αναλύθηκε για την πλήρη κοόρτη που τυχαιοποιήθηκε (κατά την έναρξη της μελέτης ή κατά το έτος 1) σε INEGY (n=4650) ή σε εικονικό φάρμακο (n=4620) όπως επίσης και τα στοιχεία αυτής της σύνθεσης.
Το κύριο τελικό σημείο της ανάλυσης έδειξε ότι το INEGY μείωσε σημαντικά τον κίνδυνο μειζόνων αγγειακών συμβαμάτων (749 ασθενείς με συμβάματα στην ομάδα με εικονικό φάρμακο έναντι 639 στην ομάδα του INEGY) με μείωση του σχετικού κινδύνου κατά 16% (p=0,001).
Ωστόσο, ο σχεδιασμός αυτής της μελέτης δεν επέτρεψε μια διακριτή συμβολή της εζετιμίμπης ως μεμονωμένης δραστικής ουσίας στην αποτελεσματικότητα για την σημαντική μείωση του κινδύνου των μειζόνων αγγειακών συμβαμάτων σε ασθενείς με χρόνια νεφρική νόσο (ΧΝΝ).
Τα επιμέρους στοιχεία των Μειζόνων Αγγειακών Συμβαμάτων (MVE) σε όλους τους ασθενείς που τυχαιοποιήθηκαν παρουσιάζονται στον Πίνακα 4. Το INEGY μείωσε σημαντικά τον κίνδυνο εγκεφαλικού επεισοδίου και οποιασδήποτε επαναγγείωσης με μη-σημαντικές αριθμητικές διαφορές υπέρ του INEGY όσον αφορά το μη θανατηφόρο έμφραγμα του μυοκαρδίου και τον καρδιακό θάνατο.
Πίνακας 4. Μείζονα Αγγειακά Συμβάματα ανά Ομάδα Θεραπείας στους ασθενείς που τυχαιοποιήθηκαν στην μελέτη SHARPα
| Έκβαση | INEGY 10/20 (N=4650) | Εικονικό φάρμακο (N=4620) | Αναλογία Κινδύνου (95% CI) | P-value |
|---|---|---|---|---|
| Μείζονα Αγγειακά Συμβάματα | 701 (15,1%) | 814 (17,6%) | 0,85 (0,77-0,94) | 0,001 |
| Μη θανατηφόρο Έμφραγμα Μυοκαρδίου | 134 (2,9%) | 159 (3,4%) | 0,84 (0,66-1,05) | 0,12 |
| Καρδιακός θάνατος | 253 (5,4%) | 272 (5,9%) | 0,93 (0,78-1,10) | 0,38 |
| Οποιοδήποτε εγκεφαλικό επεισόδιο | 171 (3,7%) | 210 (4,5%) | 0,81 (0,66-0,99) | 0,038 |
| Μη-αιμορραγικό αγγειακό εγκεφαλικό επεισόδιο | 131 (2,8%) | 174 (3,8%) | 0,75 (0,60-0,94) | 0,011 |
| Αιμορραγικό αγγειακό εγκεφαλικό επεισόδιο | 45 (1,0%) | 37 (0,8%) | 1,21 (0,78-1,86) | 0,40 |
| Οποιαδήποτε επαναγγείωση | 284 (6,1%) | 352 (7,6%) | 0,79 (0,68-0,93) | 0,004 |
| Μείζονα Αθηροσκληρωτικά Συμβάματα (ΜΑΕ)β | 526 (11,3%) | 619 (13,4%) | 0,83 (0,74-0,94) | 0,002 |
α Ανάλυση πρόθεσης-για-θεραπεία σε όλους τους ασθενείς της μελέτης SHARP που τυχαιοποιήθηκαν να λάβουν INEGY ή εικονικό φάρμακο είτε κατά την έναρξη είτε κατά τον χρόνο 1.
β MAE; ορίζεται ως σύνθεση μη θανατηφόρου εμφράγματος του μυοκαρδίου, στεφανιαίος θάνατος, μη-αιμορραγικό αγγειακό εγκεφαλικό επεισόδιο ή οποιαδήποτε επαναγγείωση.|
Η απόλυτη μείωση της LDL χοληστερόλης που επιτεύχθηκε με το INEGY ήταν χαμηλότερη μεταξύ ασθενών με χαμηλή LDL-C πριν από την έναρξη της αγωγής (<2,5 mmol/l) και ασθενών που υποβάλλονταν σε αιμοκάθαρση κατά την έναρξη απ‘ότι σε άλλους ασθενείς και οι αντίστοιχες μειώσεις κινδύνου σ’αυτές τις δύο ομάδες κινδύνου εξασθένησαν.
Στένωση Αορτής
Η μελέτη σιμβαστατίνης και εζετιμίμπης για τη θεραπεία της στένωσης της αορτής (SEAS), ήταν μία πολυκεντρική, διπλά-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη, με μέση διάρκεια 4,4 χρόνια η οποία διεξήχθη σε 1.873 ασθενείς με ασυμπτωματική στένωση αορτής (AS), τεκμηριωμένη με Doppler μέτρησης μέγιστης ταχύτητας ροής στην αορτική βαλβίδα εντός των ορίων 2,5 έως 4,0 m/s. Εντάχθηκαν μόνο οι ασθενείς, οι οποίοι δε θεωρήθηκε ότι χρειάζονται θεραπεία με στατίνη για τη μείωση του κινδύνου αθηροσκληρωτικής καρδιαγγειακής νόσου. Οι ασθενείς τυχαιοποιήθηκαν σε αναλογία 1:1 για να λάβουν θεραπεία με εικονικό φάρμακο ή με συγχορήγηση εζετιμίμπης 10 mg και σιμβαστατίνης 40 mg ημερησίως.
Το κύριο τελικό σημείο ήταν ο συνδυασμός καρδιαγγειακών συμβαμάτων μείζονος σημασίας (MCE), όπως καρδιαγγειακού θανάτου, χειρουργικής επέμβασης για αντικατάσταση της αορτικής βαλβίδας (AVR), συμφορητικής καρδιακής ανεπάρκειας (CHF) σαν αποτέλεσμα επιδείνωσης της στένωσης της αορτής, μη θανατηφόρο έμφραγμα του μυοκαρδίου, παράκαμψη με μόσχευμα της στεφανιαίας αρτηρίας (CABG), διαδερμική στεφανιαία παρέμβαση (PCI), νοσηλεία λόγω ασταθούς στηθάγχης και μη αιμορραγικού εγκεφαλικού επεισοδίου. Τα σημαντικά δευτερεύοντα τελικά σημεία ήταν συνδυασμοί υποσυνόλων των κατηγοριών συμβαμάτων κύριων τελικών σημείων.
Σε σύγκριση με το εικονικό φάρμακο, εζετιμίμπη/σιμβαστατίνη 10/40 mg δεν μείωσε σημαντικά τον κίνδυνο MCE. Το πρωταρχικό αποτέλεσμα παρουσιάσθηκε σε 333 ασθενείς (35,3%) στην ομάδα εζετιμίμπη/σιμβαστατίνη και σε 355 ασθενείς (38,2%) στην ομάδα με το εικονικό φάρμακο (ποσοστό κινδύνου στην ομάδα εζετιμίμπη/σιμβαστατίνη 0,96, 95% CI ,0,83 έως 1,12, p=0,59). Η αντικατάσταση της αορτικής βαλβίδας διεξήχθη σε 267 ασθενείς (28,3%) στην ομάδα εζετιμίμπη/σιμβαστατίνη και σε 278 ασθενείς (29,9%) στην ομάδα με το εικονικό φάρμακο (ποσοστό κινδύνου 1,00, 95% CI 0,84, έως 1,18, p=0,97). Μερικοί ασθενείς είχαν ισχαιμικά καρδιαγγειακά επεισόδια στην ομάδα με εζετιμίμπη/σιμβαστατίνη (n=148) από ό,τι στην ομάδα με το εικονικό φάρμακο (n=187) (ποσοστό κινδύνου 0,78, 95% CI ,0,63 έως 0,97, p=0,02), κυρίως λόγω του μικρότερου αριθμού ασθενών που είχαν υποβληθεί σε επέμβαση παράκαμψης με μόσχευμα στεφανιαίας αρτηρίας.
Καρκίνος εμφανίστηκε περισσότερο συχνά στην ομάδα εζετιμίμπης/σιμβαστατίνης (105 έναντι 70, p=0,01). Η κλινική σημασία αυτής της παρατήρησης δεν είναι βέβαιη καθώς στην μεγαλύτερη δοκιμή SHARP, ο συνολικός αριθμός ασθενών με οποιοδήποτε περιστατικό καρκίνου (438 στην ομάδα εζετιμίμπης/συμβαστατίνης έναντι 439 στην ομάδα με το εικονικό φάρμακο) δεν διέφερε. Επιπρόσθετα, στην κλινική δοκιμή IMPROVE-IT ο συνολικός αριθμός ασθενών με οποιαδήποτε νέακακοήθεια (853 στην ομάδα της εζετιμίμπης/σιμβαστατίνης έναντι 863 στην ομάδα της σιμβαστατίνης) δεν διέφερε σημαντικά και επομένως το αποτέλεσμα της δοκιμής SEAS δεν μπορούσε να επιβεβαιωθεί από την SHARP ή την IMPROVE-IT.
Φαρμακοκινητική
Δεν παρατηρήθηκε καμία κλινικά σημαντική αλληλεπίδραση φαρμακοκινητικής όταν συγχορηγήθηκε εζετιμίμπη με σιμβαστατίνη.
Απορρόφηση
INEGY
Το INEGY είναι βιοϊσοδύναμο με τη συγχορήγηση της εζετιμίμπης και της σιμβαστατίνης.
Εζετιμίμπη
Κατόπιν χορήγησης από το στόμα, η εζετιμίμπη απορροφάται ταχέως και συζεύγνυται σε μεγάλο βαθμό σε ένα φαρμακολογικά ενεργό φαινολικό γλυκουρονίδιο (γλυκουρονίδιο εζετιμίμπης). Οι μέσες μέγιστες συγκεντρώσεις στο πλάσμα (Cmax) απαντώνται μέσα σε 1 έως 2 ώρες για το γλυκουρονίδιο της εζετιμίμπης και 4 έως 12 ώρες για την εζετιμίμπη. H απόλυτη βιοδιαθεσιμότητα της εζετιμίμπης δεν μπορεί να προσδιορισθεί επειδή το συστατικό είναι ουσιαστικά αδιάλυτο σε υδατικά διαλύματα, κατάλληλα για ενέσιμα.
Η ταυτόχρονη χορήγηση τροφής (γεύματα πλούσια σε λιπαρά ή μη λιπαρά), δεν έχει επίδραση στην βιοδιαθεσιμότητα της από του στόματος χορηγούμενης εζετιμίμπης, όταν αυτή χορηγήθηκε ως δισκία 10 mg.
Σιμβαστατίνη
Η διαθεσιμότητα του δραστικού β-υδρόξυ οξέος στη συστηματική κυκλοφορία, μετά από μία από του στόματος χορήγηση σιμβαστατίνης, βρέθηκε ότι είναι μικρότερη από 5% της δόσης, κάτι που είναι συμβατό με την εκτενή αποβολή πρώτης διόδου στο ήπαρ. Οι κύριοι μεταβολίτες της σιμβαστατίνης στο ανθρώπινο πλάσμα είναι το β-υδρόξυ οξύ και τέσσερις επιπλέον δραστικοί μεταβολίτες.
Σχετικά με την κατάσταση νηστείας, τα επίπεδα στο πλάσμα τόσο του δραστικού όσο και όλων των αναστολέων δεν επηρεάσθηκαν όταν η σιμβαστατίνη χορηγήθηκε αμέσως πριν από ένα δοκιμαστικό γεύμα.
Κατανομή
Eζετιμίμπη
Η εζετιμίμπη και το γλυκουρονίδιο της εζετιμίμπης δεσμεύονται κατά 99,7% και 88 έως 92% με τις ανθρώπινες πρωτεΐνες του πλάσματος, αντιστοίχως.
Σιμβαστατίνη
Η σιμβαστατίνη και το β-υδρόξυ οξύ δεσμεύονται με τις ανθρώπινες πρωτεΐνες του πλάσματος (95%).
Η φαρμακοκινητική των απλών και πολλαπλών δόσεων της σιμβαστατίνης έδειξε ότι δεν παρουσιάζεται συσσώρευση του φαρμακευτικού προϊόντος μετά από πολλαπλή δοσολογία. Σε όλες τις παραπάνω μελέτες φαρμακοκινητικής, η μέγιστη συγκέντρωση στο πλάσμα των αναστολέων παρουσιάσθηκε 1,3 έως 2,4 ώρες μετά τη χορήγηση.
Βιομετασχηματισμός
Eζετιμίμπη
Η εζετιμίμπη μεταβολίζεται πρωταρχικά στο λεπτό έντερο και στο ήπαρ μέσω σύζευξης σε γλυκουρονίδιο (αντίδραση φάσης II) με επακόλουθη χολική απέκκριση. Παρατηρήθηκε ελάχιστος οξειδωτικός μεταβολισμός (αντίδραση φάσης Ι) σε όλα τα είδη που αξιολογήθηκαν. Η εζετιμίμπη και το γλυκουρονίδιο της εζετιμίμπης είναι τα κύρια παράγωγα του φαρμάκου που ανιχνεύθηκαν στο πλάσμα αποτελώντας περίπου 10 έως 20% και 80 έως 90% του συνολικού φαρμάκου στο πλάσμα αντιστοίχως. Αμφότερα, η εζετιμίμπη και το γλυκουρονίδιο της εζετιμίμπης απεκκρίνονται βραδέως από το πλάσμα με αποδεδειγμένη σημαντική εντεροηπατική ανακύκλωση. Ο χρόνος ημίσειας ζωής της εζετιμίμπης και του γλυκουρονίδιου της εζετιμίμπης είναι περίπου 22 ώρες.
Σιμβαστατίνη
Η σιμβαστατίνη είναι μία ανενεργός λακτόνη, που εύκολα υδρολύεται in vivo στο αντίστοιχο β-υδρόξυ οξύ, έναν ισχυρό αναστολέα της HMG-CoA αναγωγάσης. Η υδρόλυση λαμβάνει χώρα κυρίως στο ήπαρ και ο ρυθμός υδρόλυσης στο ανθρώπινο πλάσμα είναι πολύ βραδύς.
Στον άνθρωπο η σιμβαστατίνη απορροφάται καλά και υφίσταται εκτενή απέκκριση πρώτης διόδου στο ήπαρ. Η απέκκριση στο ήπαρ εξαρτάται από την ηπατική ροή του αίματος. Το ήπαρ είναι η κύρια περιοχή δράσης με επακόλουθη απέκκριση ισοδύναμων ενώσεων του φαρμακευτικού προϊόντος στη χολή. Συνεπώς η διαθεσιμότητα της δραστικής ουσίας στη συστηματική κυκλοφορία είναι μικρή.
Κατόπιν ενδοφλέβιας έγχυσης του μεταβολίτη β-υδρόξυ οξύ, ο χρόνος ημίσειας ζωής κυμαίνονταν στις 1,9 ώρες.
Αποβολή
Eζετιμίμπη
Κατόπιν χορήγησης από του στόματος 14C-εζετιμίμπης (20 mg) σε ανθρώπους, η συνολική εζετιμίμπη αποτελούσε περίπου το 93% της συνολικής ραδιενέργειας στο πλάσμα. Περίπου 78% και 11% της χορηγηθείσας ραδιενέργειας επανακτήθηκε στα κόπρανα και στα ούρα αντιστοίχως κατά τη διάρκεια συλλογής 10 ημερών. Μετά από 48 ώρες, δεν υπήρχαν ανιχνεύσιμα επίπεδα ραδιενέργειας στο πλάσμα.
Σιμβαστατίνη
Το οξύ της σιμβαστατίνης μεταφέρεται ενεργά εντός των ηπατικών κυττάρων από τον μεταφορέα ΟΑΤP1B1.
Η σιμβαστατίνη είναι ένα υπόστρωμα του μεταφορέα εκροής της BCRP.
Κατόπιν χορήγησης από του στόματος ραδιενεργού σιμβαστατίνης στον άνθρωπο, 13% της ραδιενέργειας απεκκρίθηκε στα ούρα και 60% στα κόπρανα εντός 96 ωρών. Το ποσό που ανακτήθηκε στα κόπρανα αποτελεί το απορροφημένο φαρμακευτικό προϊόν ισοδύναμο με αυτό που απεκκρίθηκε στη χολή καθώς επίσης μη απορροφημένο φαρμακευτικό προϊόν. Κατόπιν ενδοφλέβιας ένεσης του μεταβολίτη β-υδρόξυ οξύ, μόνο 0,3%, κατά μέσο όρο, της ενδοφλέβιας δόσης απεκκρίθηκε στα ούρα με μορφή αναστολέων.
Ειδικοί πληθυσμοί
Παιδιατρικός Πληθυσμός
Η απορρόφηση και ο μεταβολισμός της εζετιμίμπης ήταν παρόμοιοι μεταξύ παιδιών και εφήβων (10 έως 18 ετών) και ενηλίκων. Με βάση τη συνολική εζετιμίμπη, δεν υπάρχουν φαρμακοκινητικές διαφορές μεταξύ εφήβων και ενηλίκων. Δεν υπάρχουν διαθέσιμα στοιχεία φαρμακοκινητικής στον παιδιατρικό πληθυσμό ηλικίας <10 ετών. Η κλινική εμπειρία σε παιδιατρικούς και έφηβους ασθενείς περιλαμβάνει ασθενείς με ομόζυγο οικογενή υπερχοληστερολαιμία (HoFH), ετερόζυγο οικογενή υπερχοληστερολαιμία (HeFH) ή σιτοστερολαιμία. (Bλέπε παράγραφο 4.2).
Ηλικιωμένοι
Οι συγκεντρώσεις στο πλάσμα για την ολική εζετιμίμπη ήταν περίπου 2-φορές υψηλότερες στους ηλικιωμένους (≥65 ετών) από ό,τι στους νέους (18 έως 45 ετών). Η μείωση της LDL-C και το προφίλ ασφάλειας είναι συγκρίσιμα μεταξύ των ηλικιωμένων και νέων ατόμων που έλαβαν θεραπεία με εζετιμίμπη. (Bλέπε παράγραφο 4.2).
Ηπατική δυσλειτουργία
Μετά από μία εφάπαξ δόση εζετιμίμπης 10 mg, η μέση συγκέντρωση κάτω από την καμπύλη AUC για την ολική εζετιμίμπη αυξήθηκε περίπου κατά 1,7-φορές σε ασθενείς με ήπια ηπατική δυσλειτουργία (Child-Pugh score 5 ή 6) σε σύγκριση με υγιή άτομα. Σε μία πολλαπλών δόσεων μελέτη διάρκειας 14 ημερών (10 mg ημερησίως) σε ασθενείς με μέτρια ηπατική δυσλειτουργία (Child-Pugh score 7 έως 9), η μέση ΑUC για την ολική εζετιμίμπη αυξήθηκε περίπου κατά 4 φορές κατά την ημέρα 1 και ημέρα 14 σε σύγκριση με υγιή άτομα. Δεν απαιτήθηκε αναπροσαρμογή της δοσολογίας για ασθενείς με ήπια ηπατική δυσλειτουργία. Λόγω των άγνωστων επιδράσεων της αυξημένης έκθεσης στην εζετιμίμπη σε ασθενείς με μέτρια ή σοβαρή (Child-Pugh score >9) ηπατική δυσλειτουργία, η εζετιμίμπη δεν συνιστάται σ' αυτούς τους ασθενείς (βλέπε παραγράφους 4.2 και 4.4).
Νεφρική δυσλειτουργία
Εζετιμίμπη: Μετά από μία εφάπαξ δόση 10 mg εζετιμίμπης σε ασθενείς με σοβαρή νεφρική νόσο (n=8, μέση κάθαρση κρεατινίνης CrCl ≤30 ml/min) η μέση AUC για την ολική εζετιμίμπη αυξήθηκε περίπου κατά 1,5 φορές σε σύγκριση με υγιή άτομα (n=9). (Βλέπε παράγραφο 4.2).
Ένας επιπλέον ασθενής σε αυτή τη μελέτη (με μεταμόσχευση νεφρού και λαμβάνοντας πολλαπλές δόσεις φαρμάκων, συμπεριλαμβανομένης της κυκλοσπορίνης) είχε 12 φορές μεγαλύτερη έκθεση στην ολική εζετιμίμπη.
Σιμβαστατίνη: Σε μία μελέτη σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (κάθαρση κρεατινίνης <30 ml/min), οι συγκεντρώσεις του πλάσματος των ολικών αναστολέων μετά από μία εφάπαξ δόση ενός σχετικού με την αναγωγάση HMG-CoA αναστολέα ήταν περίπου δύο φορές μεγαλύτερες από αυτές των υγιών εθελοντών.
Φύλο
Οι συγκεντρώσεις στο πλάσμα για την ολική εζετιμίμπη ήταν ελαφρά μεγαλύτερες (περίπου 20%) σε γυναίκες από ό,τι σε άνδρες. Η μείωση LDL-C και το προφίλ ασφάλειας είναι συγκρίσιμα μεταξύ των ανδρών και των γυναικών που έλαβαν θεραπεία με εζετιμίμπη.
Πολυμορφισμός SLCO1B1
Οι φορείς του αλληλόμορφου c.521T>C του γονιδίου SLCO1B1 έχουν χαμηλότερη ΟΑΤP1B1 δραστικότητα. Η μέση έκθεση (AUC) στον κύριο δραστικό μεταβολίτη, το οξύ της σιμβαστατίνης είναι 120% σε ετεροζυγώτες φορείς (CT) του αλληλόμορφου C και 221% σε ομοζυγώτες (CC) φορείς του σε σχέση με εκείνη σε ασθενείς που έχουν τον πιο κοινό γονότυπο (TT). Το αλληλόμορφο C έχει μια συχνότητα εμφάνισης 18% στον Ευρωπαϊκό πληθυσμό. Σε ασθενείς με πολυμορφισμό SLCO1B1, υπάρχει ο κίνδυνος αυξημένης έκθεσης στο οξύ της σιμβαστατίνης, η οποία μπορεί να οδηγήσει σε αυξημένο κίνδυνο ραβδομυόλυσης (βλ. παράγραφο 4.4).
Προκλινικά δεδομένα για την ασφάλεια
INEGY
Σε μελέτες συνδυασμού με εζετιμίμπη και σιμβαστατίνη οι τοξικές επιδράσεις που παρατηρήθηκαν ήταν ουσιαστικά οι τυπικές αντιδράσεις που σχετίζονται με στατίνες. Μερικές από τις τοξικές αντιδράσεις ήταν περισσότερο έντονες από ό,τι είχαν παρατηρηθεί κατά τη διάρκεια της θεραπείας μόνον με στατίνες. Αυτό αποδίδεται σε φαρμακοκινητικές και/ή φαρμακοδυναμικές αλληλεπιδράσεις μετά από χορήγηση συνδυασμένης θεραπείας. Τέτοιες αλληλεπιδράσεις δεν εμφανίσθηκαν στις κλινικές μελέτες. Μυοπάθειες εμφανίσθηκαν σε αρουραίους μόνον μετά από έκθεση σε δόσεις οι οποίες ήταν αρκετές φορές μεγαλύτερες από ό,τι η ανθρώπινη θεραπευτική δόση (περίπου 20 φορές το επίπεδο AUC για σιμβαστατίνη και 1.800 φορές το επίπεδο AUC για τον ενεργό μεταβολίτη). Δεν υπήρξε απόδειξη ότι η συγχορήγηση της εζετιμίμπης επηρέασε την μυοτοξική δυνατότητα της σιμβαστατίνης.
Σε σκύλους στους οποίους συγχορηγήθηκε εζετιμίμπη και στατίνες, παρατηρήθηκαν σε χαμηλή έκθεση επιδράσεις στο ήπαρ (<1 φορά της ανθρώπινης AUC). Παρατηρήθηκαν σημαντικές αυξήσεις των ηπατικών ενζύμων (ALT, AST) με απουσία ιστικής νέκρωσης. Παρατηρήθηκαν ιστοπαθολογικά ευρήματα στο ήπαρ (υπερπλασία του χοληδόχου πόρου, συσσώρευση χρωστικών, διήθηση μονοπύρηνων κυττάρων και μικρών ηπατοκυττάρων) σε σκύλους στους οποίους συγχορηγήθηκε εζετιμίμπη και σιμβαστατίνη. Αυτές οι αλλαγές δεν παρουσίασαν εξέλιξη με την παράταση της δόσης έως 14 μήνες. Γενική υποχώρηση των ηπατικών ευρημάτων παρατηρήθηκε με την διακοπή της δόσης. Αυτά τα ευρήματα ήταν σε συμφωνία με εκείνα που έχουν περιγραφεί με αναστολείς HMG-CoA ή αποδίδονται στα πολύ χαμηλά επίπεδα χοληστερόλης που παρατηρήθηκαν στους προσβεβλημένους σκύλους.
Η ταυτόχρονη χορήγηση της εζετιμίμπης και της σιμβαστατίνης δεν ήταν τερατογόνος σε αρουραίους. Σε κουνέλια σε κατάσταση κύησης παρατηρήθηκε ένας μικρός αριθμός σκελετικών δυσμορφιών (συγκερασμός ουραίων σπονδύλων, μειωμένος αριθμός ουραίων σπονδύλων).
Σε μία σειρά δοκιμών in vivo και in vitro η εζετιμίμπη, που χορηγήθηκε μόνη ή σε συνδυασμό με σιμβαστατίνη, δεν παρουσίασε γονοτοξικό δυναμικό.
Εζετιμίμπη
Μελέτες σε ζώα για χρόνια τοξικότητα της εζετιμίμπης δεν προσδιόρισαν κάποιο όργανο-στόχο για τοξικές επιδράσεις. Σε σκύλους που έλαβαν για 4 εβδομάδες εζετιμίμπη (≥0,03 mg/kg ημερησίως) η συγκέντρωση χοληστερόλης στην χοληδόχο κύστη αυξήθηκε κατά 2,5 έως 3,5 φορές. Ωστόσο, σε μία μελέτη ενός έτους σε σκύλους που έλαβαν δόσεις έως 300 mg/kg ημερησίως, δεν παρατηρήθηκε αυξημένη συχνότητα χολολιθίασης ή άλλες ηπατοχολικές επιδράσεις. Η σημασία αυτών των στοιχείων για τους ανθρώπους δεν είναι γνωστή. Δεν μπορεί να αποκλεισθεί ο κίνδυνος λιθογένεσης που σχετίζεται με τη θεραπευτική χορήγηση της εζετιμίμπης.
Έλεγχοι καρκινογένεσης μακράς διάρκειας με την εζετιμίμπη ήταν αρνητικοί.
Η εζετιμίμπη δεν είχε επίδραση στην γονιμότητα αρσενικών ή θηλυκών αρουραίων, ούτε βρέθηκε ότι είναι τερατογόνος σε αρουραίους ή κουνέλια, ούτε ότι είχε επίδραση στην προγεννητική ή μεταγεννητική ανάπτυξη. Η εζετιμίμπη διαπερνά τον φραγμό του πλακούντα σε αρουραίους σε κατάσταση κύησης και κουνέλια που έλαβαν πολλαπλές δόσεις των 1.000 mg/kg ημερησίως.
Σιμβαστατίνη
Βάσει συμβατικών μελετών σε ζώα σχετικά με την φαρμακοδυναμική, τοξικότητα επαναλαμβανόμενων δόσεων, γονοτοξικότητα και καρκινογένεση, δεν υπάρχουν άλλοι κίνδυνοι για τον ασθενή που μπορεί να αναμένονται σε σχέση με το φαρμακολογικό μηχανισμό. Στις μέγιστες ανεκτές δόσεις τόσο σε αρουραίους όσο και σε κουνέλια, η σιμβαστατίνη δεν προκάλεσε εμβρυϊκές δυσμορφίες και δεν είχε καμία επίδραση στη γονιμότητα, στην αναπαραγωγική λειτουργία ή την ανάπτυξη του νεογέννητου.
Καρκινογένεση, μεταλλάξεις, στείρωση
Γονιμότητα
Εζετιμίμπη
Δεν υπάρχουν διαθέσιμα δεδομένα κλινικών δοκιμών σχετικά με τις επιδράσεις της εζετιμίμπης στη γονιμότητα του ανθρώπου. Η εζετιμίμπη δεν είχε καμία επίδραση στη γονιμότητα αρσενικών ή θηλυκών αρουραίων (βλέπε παράγραφο 5.3).
Σιμβαστατίνη
Δεν υπάρχουν διαθέσιμα δεδομένα κλινικών δοκιμών σχετικά με τις επιδράσεις της σιμβαστατίνης στη γονιμότητα του ανθρώπου. Η σιμβαστατίνη δεν είχε καμία επίδραση στη γονιμότητα αρσενικών και θηλυκών αρουραίων (βλέπε παράγραφο 5.3).
Ενεργά συστατικά
|
EOR26LQQ24 - EZETIMIBE
|
|
AGG2FN16EV - SIMVASTATIN
|
Σχετικό SPC
INEGY Δισκία 10 mg/10 mg, 10 mg/20 mg ή 10 mg/40 mg.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.