PAXLOVID F.C.TAB 150MG/TAB BT X 30 ΔΙΣΚΙΑ (BLIST 5 Χ 4 ΔΙΣΚΙΑ) (PINK) - ΜΕ PF-07321332 + (BLIST 5 X 2 ΔΙΣΚΙΑ) (WHITE) - ΜΕ RITONAVIR ΣΕ BLISTERS OPA/AL/PVC FOIL
Αντενδείξεις
Υπερευαισθησία στις δραστικές ουσίες ή σε οποιοδήποτε από τα έκδοχα που αναφέρονται στην παράγραφο 6.1.
Φαρμακευτικά προϊόντα των οποίων η κάθαρση εξαρτάται σε μεγάλο βαθμό από το CYP3A και για τα οποία οι αυξημένες συγκεντρώσεις σχετίζονται με σοβαρές ή/και απειλητικές για τη ζωή αντιδράσεις.
Φαρμακευτικά προϊόντα που είναι ισχυροί επαγωγείς του CYP3A, όπου οι σημαντικά μειωμένες συγκεντρώσεις του PF-07321332/ριτοναβίρη στο πλάσμα μπορεί να σχετίζονται με το ενδεχόμενο απώλειας της ιολογικής ανταπόκρισης και πιθανή αντοχή.
Το Paxlovid δεν μπορεί να ξεκινήσει αμέσως μετά τη διακοπή οποιουδήποτε από τα ακόλουθα φαρμακευτικά προϊόντα λόγω της καθυστερημένης αντιστάθμισης του επαγωγέα του CYP3A που διεκόπη πρόσφατα (βλ. παράγραφο 4.5).
Τα φαρμακευτικά προϊόντα που αναγράφονται παρακάτω αποτελούν έναν οδηγό και δεν θεωρούνται ένας πλήρης κατάλογος όλων των πιθανών φαρμακευτικών προϊόντων τα οποία αντενδείκνυνται με το Paxlovid.
- Ανταγωνιστής των άλφα1-αδρενεργικών υποδοχέων: αλφουζοσίνη
- Αναλγητικά: πεθιδίνη, πιροξικάμη, προποξυφαίνη
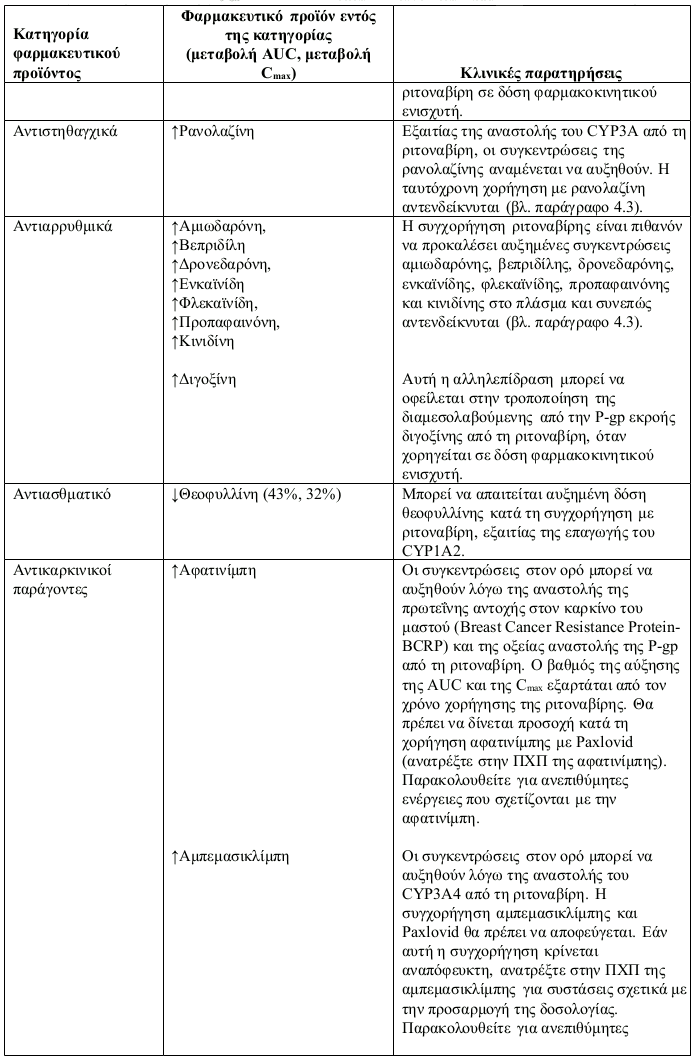
- Αντιστηθαγχικό: ρανολαζίνη
- Αντικαρκινικά φάρμακα: νερατινίμπη, βενετοκλάξη
- Αντιαρρυθμικά: αμιωδαρόνη, βεπριδίλη, δρονεδαρόνη, ενκαϊνίδη, φλεκαϊνίδη, προπαφαινόνη, κινιδίνη
- Αντιβιοτικά: φουσιδικό οξύ, ριφαμπικίνη
- Αντισπασμωδικά: καρβαμαζεπίνη, φαινοβαρβιτάλη, φαινυτοΐνη
- Κατά της ουρικής αρθρίτιδας: κολχικίνη
- Αντιισταμινικά: αστεμιζόλη, τερφεναδίνη
- Αντιψυχωσικά/νευροληπτικά: λουρασιδόνη, πιμοζίδη, κλοζαπίνη, κουετιαπίνη
- Παράγωγα ερυσιβώδους όλυρας: διυδροεργοταμίνη, εργονοβίνη, εργοταμίνη, μεθυλεργονοβίνη
- Παράγοντες κινητικότητας του γαστρεντερικού: σισαπρίδη
- Φυτικά προϊόντα: St. John’s wort (Hypericum perforatum)
- Παράγοντες τροποποίησης λιπιδίων:
- Αναστολείς της HMG CoA αναγωγάσης: λοβαστατίνη, σιμβαστατίνη
- Aναστολέας της μικροσωμιακής πρωτεΐνης μεταφοράς τριγλυκεριδίων (MTTP): λομιταπίδη
- Αναστολείς της PDE-5: αβαναφίλη, σιλντεναφίλη, βαρντεναφίλη
- Ηρεμιστικά/υπνωτικά: κλοραζεπάτη, διαζεπάμη, εσταζολάμη, φλουραζεπάμη, μιδαζολάμη από στόματος και τριαζολάμη.
Προφυλάξεις και προειδοποιήσεις
Κίνδυνος σοβαρών ανεπιθύμητων ενεργειών εξαιτίας αλληλεπιδράσεων με άλλα φαρμακευτικά προϊόντα
Η έναρξη χορήγησης του Paxlovid, ενός αναστολέα του CYP3A, σε ασθενείς που λαμβάνουν φαρμακευτικά προϊόντα που μεταβολίζονται από το CYP3A ή η έναρξη χορήγησης φαρμακευτικών προϊόντων που μεταβολίζονται από το CYP3A σε ασθενείς που ήδη λαμβάνουν Paxlovid, ενδέχεται να αυξήσει τις συγκεντρώσεις στο πλάσμα των φαρμακευτικών προϊόντων που μεταβολίζονται από το CYP3A.
Η έναρξη φαρμακευτικών προϊόντων που αναστέλλουν ή επάγουν το CYP3A ενδέχεται να αυξήσει ή να μειώσει τις συγκεντρώσεις του Paxlovid, αντίστοιχα.
Οι αλληλεπιδράσεις αυτές μπορεί να οδηγήσουν σε:
- Κλινικά σημαντικές ανεπιθύμητες ενέργειες, που ενδέχεται να οδηγήσουν σε σοβαρά, απειλητικά για τη ζωή ή θανατηφόρα συμβάντα από μεγαλύτερες εκθέσεις των συγχορηγούμενων φαρμακευτικών προϊόντων.
- Κλινικά σημαντικές ανεπιθύμητες ενέργειες από μεγαλύτερες εκθέσεις του Paxlovid.
- Απώλεια της θεραπευτικής επίδρασης του Paxlovid και πιθανή ανάπτυξη ιολογικής αντοχής.
Βλ. Πίνακα 1 για φαρμακευτικά προϊόντα τα οποία αντενδείκνυνται για ταυτόχρονη χρήση με το PF-07321332/ριτοναβίρη και για δυνητικά σημαντικές αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα (βλ. παράγραφο 4.5). Θα πρέπει να εξετάζεται το ενδεχόμενο αλληλεπιδράσεων με άλλα φαρμακευτικά προϊόντα πριν και κατά τη διάρκεια της θεραπείας με Paxlovid. Τα συγχορηγούμενα φαρμακευτικά προϊόντα θα πρέπει να επανεξετάζονται κατά τη διάρκεια της θεραπείας με Paxlovid και ο ασθενής θα πρέπει να παρακολουθείται για τις ανεπιθύμητες ενέργειες που σχετίζονται με τα συγχορηγούμενα φαρμακευτικά προϊόντα.
Σοβαρή νεφρική δυσλειτουργία
Δεν υπάρχουν διαθέσιμα κλινικά δεδομένα σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (συμπεριλαμβανομένων ασθενών με ESRD). Με βάση φαρμακοκινητικά δεδομένα (βλ. παράγραφο 5.2), η χρήση του Paxlovid σε ασθενείς με σοβαρή νεφρική δυσλειτουργία θα μπορούσε να οδηγήσει σε υπερ-έκθεση με ενδεχόμενη τοξικότητα. Δεν θα μπορούσε να γίνει σύσταση αναφορικά με την προσαρμογή της δόσης σε αυτό το στάδιο εν αναμονή εξειδικευμένης διερεύνησης. Συνεπώς, το Paxlovid δεν θα πρέπει να χρησιμοποιείται σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (eGFR <30 mL/min, συμπεριλαμβανομένων των ασθενών με ESRD υπό αιμοκάθαρση).
Σοβαρή ηπατική δυσλειτουργία
Δεν υπάρχουν διαθέσιμα φαρμακοκινητικά και κλινικά δεδομένα σε ασθενείς με σοβαρή ηπατική δυσλειτουργία. Συνεπώς το Paxlovid δεν θα πρέπει να χρησιμοποιείται σε ασθενείς με σοβαρή ηπατική δυσλειτουργία.
Ηπατοτοξικότητα
Σε ασθενείς που λαμβάνουν ριτοναβίρη έχουν παρουσιαστεί αυξήσεις των ηπατικών τρανσαμινασών, κλινική ηπατίτιδα και ίκτερος. Ως εκ τούτου, θα πρέπει να δίνεται προσοχή κατά τη χορήγηση του Paxlovid σε ασθενείς με προϋπάρχουσες ηπατικές παθήσεις, διαταραχές των ηπατικών ενζύμων ή ηπατίτιδα.
Κίνδυνος ανάπτυξης αντοχής του HIV-1
Επειδή το PF-07321332 συγχορηγείται με ριτοναβίρη, ενδέχεται να υπάρχει κίνδυνος ανάπτυξης αντοχής του HIV-1 στους αναστολείς πρωτεάσης του HIV σε άτομα με μη ελεγχόμενη ή αδιάγνωστη λοίμωξη από HIV-1.
Έκδοχα
Τα δισκία PF-07321332 περιέχουν λακτόζη. Οι ασθενείς με σπάνια κληρονομικά προβλήματα δυσανεξίας στη γαλακτόζη, ολική ανεπάρκεια λακτάσης ή δυσαπορρόφηση γλυκόζης-γαλακτόζης δεν θα πρέπει να λαμβάνουν αυτό το φάρμακο.
Τα δισκία PF-07321332 και ριτοναβίρης περιέχουν το καθένα λιγότερο από 1 mmol νατρίου (23 mg) ανά δόση, δηλαδή ουσιαστικά είναι «ελεύθερα νατρίου».
Ασυμβατότητες
Δεν εφαρμόζεται.
Ανεπιθύμητες ενέργειες
Σύνοψη του προφίλ ασφάλειας
Οι πιο συχνές ανεπιθύμητες ενέργειες, που αναφέρθηκαν κατά τη διάρκεια της θεραπείας με Paxlovid (PF-07321332 300 mg / ριτοναβίρη 100 mg) κάθε 12 ώρες επί 5 ημέρες και κατά τη διάρκεια 34 ημερών μετά την τελευταία δόση ήταν δυσγευσία (5,6%), διάρροια (3,1%), κεφαλαλγία (1,4%) και έμετος (1,1%).
Σύνοψη ανεπιθύμητων ενεργειών σε μορφή πίνακα
Οι ανεπιθύμητες ενέργειες στον Πίνακα 2 παρατίθενται παρακάτω ανά κατηγορία/οργανικό σύστημα και συχνότητα. Οι συχνότητες ορίζονται ως εξής: Πολύ συχνές (≥1/10), συχνές (≥1/100 έως <1/10), όχι συχνές (≥1/1000 έως <1/100), σπάνιες (≥1/10.000 έως <1/1000), μη γνωστές (η συχνότητα δεν μπορεί να εκτιμηθεί από τα διαθέσιμα δεδομένα).
Πίνακας 2. Ανεπιθύμητες ενέργειες με το Paxlovid:
| Κατηγορία/οργανικό σύστημα | Κατηγορία συχνότητας | Ανεπιθύμητες ενέργειες |
|---|---|---|
| Διαταραχές του νευρικού συστήματος | Συχνές | Δυσγευσία, κεφαλαλγία |
| Διαταραχές του γαστρεντερικού συστήματος | Συχνές | Διάρροια, έμετος |
Αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών
Η αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών μετά από τη χορήγηση άδειας κυκλοφορίας του φαρμακευτικού προϊόντος είναι σημαντική. Επιτρέπει τη συνεχή παρακολούθηση της σχέσης οφέλους-κινδύνου του φαρμακευτικού προϊόντος. Ζητείται από τους επαγγελματίες υγείας να αναφέρουν οποιεσδήποτε πιθανολογούμενες ανεπιθύμητες ενέργειες μέσω του εθνικού συστήματος αναφοράς που αναγράφεται στο Παράρτημα V.
Αλληλεπιδράσεις με άλλα φάρμακα ή ουσίες
Το Paxlovid (PF-07321332/ριτοναβίρη) είναι ένας αναστολέας του CYP3A και μπορεί να αυξήσει τις συγκεντρώσεις στο πλάσμα των φαρμακευτικών προϊόντων που μεταβολίζονται κυρίως από το CYP3A. Τα φαρμακευτικά προϊόντα που μεταβολίζονται εκτενώς από το CYP3A και έχουν υψηλό μεταβολισμό πρώτης διόδου φαίνεται να είναι τα πιο επιρρεπή σε μεγάλες αυξήσεις της έκθεσης όταν συγχορηγούνται με PF-07321332/ριτοναβίρη. Συνεπώς, η συγχορήγηση PF-07321332/ριτοναβίρης αντενδείκνυται με φαρμακευτικά προϊόντα των οποίων η κάθαρση εξαρτάται σε μεγάλο βαθμό από το CYP3A και για τα οποία οι αυξημένες συγκεντρώσεις στο πλάσμα σχετίζονται με σοβαρά ή/και απειλητικά για τη ζωή συμβάντα (βλ. Πίνακα 1).
Η ριτοναβίρη έχει υψηλή συγγένεια για αρκετές ισομορφές του κυτοχρώματος P450 (CYP) και μπορεί να αναστείλει την οξείδωση με την παρακάτω ιεραρχημένη σειρά: CYP3A4 > CYP2D6. Η ριτοναβίρη έχει επίσης υψηλή συγγένεια για την P-γλυκοπρωτεΐνη (P-gp) και μπορεί να αναστείλει αυτόν τον μεταφορέα. Η ριτοναβίρη μπορεί να επάγει γλυκουρονιδίωση και οξείδωση από τα CYP1A2, CYP2C8, CYP2C9 και CYP2C19, αυξάνοντας έτσι τον βιομετασχηματισμό ορισμένων φαρμακευτικών προϊόντων που μεταβολίζονται μέσω αυτών των οδών και μπορεί να προκαλέσει μειωμένη συστημική έκθεση σε αυτά τα φαρμακευτικά προϊόντα, κάτι που θα μπορούσε να μειώσει ή να συντομεύσει τη θεραπευτική τους επίδραση.
Η συγχορήγηση άλλων υποστρωμάτων του CYP3A4 που μπορεί να οδηγήσει σε δυνητικά σημαντική αλληλεπίδραση (βλ. Πίνακα 1) θα πρέπει να εξετάζεται μόνο εφόσον τα οφέλη υπερτερούν των κινδύνων.
Το PF-07321332 και η ριτοναβίρη είναι υποστρώματα του CYP3A. Κατά συνέπεια, τα φαρμακευτικά προϊόντα που επάγουν το CYP3A μπορεί να μειώσουν τις συγκεντρώσεις του PF-07321332 και της ριτοναβίρης στο πλάσμα, και να μειώσουν τη θεραπευτική επίδραση του Paxlovid.
Ως συντηρητικό μέτρο, οι φαρμακευτικές αλληλεπιδράσεις που αφορούν στη ριτοναβίρη που χρησιμοποιείται στη χρόνια λοίμωξη από HIV (600 mg 2 φορές ημερησίως όταν χρησιμοποιήθηκε αρχικά ως αντιρετροϊκός παράγοντας και 100 mg 2 φορές ημερησίως όπως χρησιμοποιείται επί του παρόντος ως φαρμακοκινητικός ενισχυτής με αντιρετροϊκούς παράγοντες), θα πρέπει να εφαρμόζονται για το Paxlovid. Μελλοντικές έρευνες ενδέχεται να επιτρέψουν την προσαρμογή των συστάσεων που σχετίζονται με τις φαρμακευτικές αλληλεπιδράσεις στη θεραπεία διάρκειας 5 ημερών με το Paxlovid.
Τα φαρμακευτικά προϊόντα που παρατίθενται στον Πίνακα 1 αποτελούν έναν οδηγό και δεν θεωρούνται ένας πλήρης κατάλογος όλων των πιθανών φαρμακευτικών προϊόντων τα οποία αντενδείκνυνται ή ενδέχεται να αλληλεπιδράσουν με το PF-07321332/ριτοναβίρη.
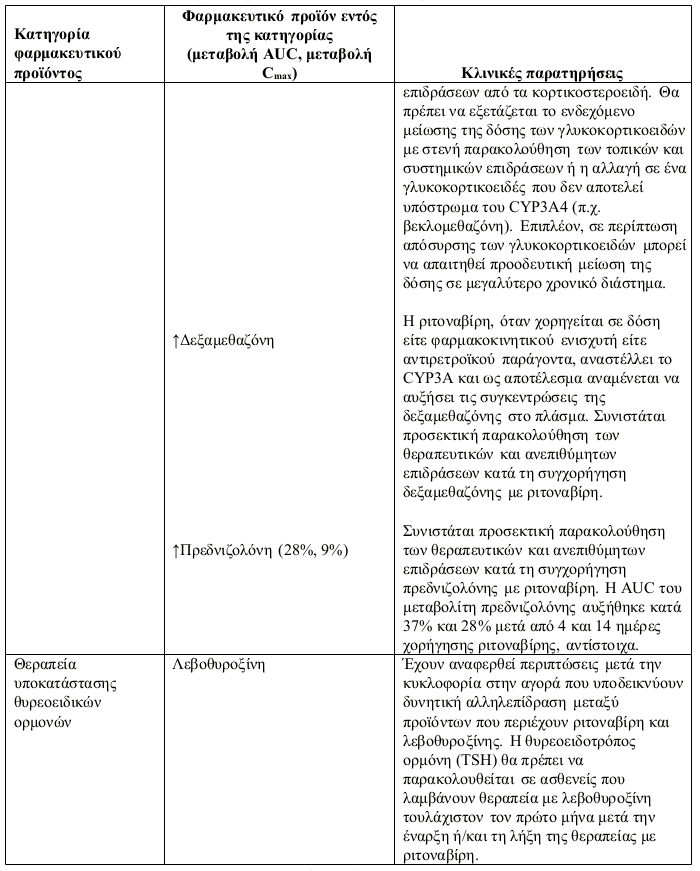
Πίνακας 1. Αλληλεπίδραση με άλλα φαρμακευτικά προϊόντα και άλλες μορφές αλληλεπίδρασης:
Συντμήσεις: ALT = αμινοτρανσφεράση αλανίνης, AUC = περιοχή κάτω από την καμπύλη
Επίδραση άλλων φαρμακευτικών προϊόντων στο PF-07321332
Η συγχορήγηση πολλαπλών δόσεων 200mg ιτρακοναζόλης από του στόματος αύξησε τις AUCtau και Cmax του PF-07321332. Οι αναλογίες των προσαρμοσμένων γεωμετρικών μέσων (90% CI) για τις AUCtau και Cmax του PF-07321332 ήταν 138,82% (129,25%, 149,11%) και 118,57% (112,50%, 124,97%), αντίστοιχα, όταν το PF-07321332/ριτοναβίρη συγχορηγήθηκε με πολλαπλές δόσεις ιτρακοναζόλης σε σύγκριση με τη χορήγηση μόνο του PF-07321332/ριτοναβίρη.
Η συγχορήγηση πολλαπλών δόσεων 300 mg καρβαμαζεπίνης από του στόματος ελάττωσε τις AUCinf και Cmax του PF-07321332. Οι αναλογίες (ratios) των προσαρμοσμένων γεωμετρικών μέσων (90% CI) για τις AUCinf και Cmax του PF-07321332 ήταν 44,50% (90% CI: 33,77%, 58,65%) και 56,82% (90% CI: 47,04%, 68,62%), αντίστοιχα, μετά τη συγχορήγηση PF-07321332/ριτοναβίρη 300mg/100mg με πολλαπλές δόσεις καρβαμαζεπίνης από του στόματος σε σύγκριση με τη χορήγηση μόνο του PF-07321332/ριτοναβίρη.
Κύηση
Δεν υπάρχουν δεδομένα σχετικά με τη χρήση του Paxlovid σε έγκυες γυναίκες.
Δεν υπήρξε επίδραση που σχετίζονταν με το PF-07321332 στη μορφολογία του εμβρύου ή στη βιωσιμότητα του εμβρύου σε οποιαδήποτε από τις δόσεις που εξετάστηκαν σε μελέτες εμβρυϊκής αναπτυξιακής τοξικότητας σε αρουραίους ή κουνέλια αν και παρατηρήθηκαν μειωμένα εμβρυϊκά σωματικά βάρη σε κουνέλια (βλ. παράγραφο 5.3).
Σε ένα μεγάλο αριθμό γυναικών που εκτέθηκαν σε ριτοναβίρη κατά τη διάρκεια της εγκυμοσύνης δεν υποδεικνύεται αύξηση του ποσοστού των συγγενών ανωμαλιών σε σύγκριση με τα ποσοστά που παρατηρούνται σε συστήματα επιτήρησης συγγενών ανωμαλιών στον πληθυσμό.
Δεδομένα σε ζώα με χορήγηση ριτοναβίρης κατέδειξαν αναπαραγωγική τοξικότητα (βλ. παράγραφο 5.3).
Το Paxlovid δεν συνιστάται κατά τη διάρκεια της εγκυμοσύνης και σε γυναίκες σε αναπαραγωγική ηλικία που δεν χρησιμοποιούν μια αποτελεσματική μέθοδο αντισύλληψης εκτός εάν η κλινική συνθήκη απαιτεί θεραπεία με Paxlovid.
Γαλουχία
Δεν υπάρχουν δεδομένα σχετικά με τη χρήση του Paxlovid σε γυναίκες που θηλάζουν.
Δεν είναι γνωστό εάν το PF-07321332 απεκκρίνεται στο ανθρώπινο ή ζωικό γάλα, και οι επιδράσεις του στο νεογνό/βρέφος που θηλάζει ή οι επιδράσεις του στην παραγωγή γάλακτος είναι επίσης άγνωστες. Σε περιορισμένα δημοσιευμένα δεδομένα αναφέρεται ότι η ριτοναβίρη απεκκρίνεται στο ανθρώπινο γάλα. Δεν υπάρχουν στοιχεία σχετικά με τις επιδράσεις της ριτοναβίρης στο νεογνό/βρέφος που θηλάζει ή στην παραγωγή γάλακτος. Ο κίνδυνος για το νεογνό/βρέφος δεν μπορεί να αποκλειστεί. Ο θηλασμός θα πρέπει να διακόπτεται προσωρινά κατά τη διάρκεια της θεραπείας και ως προληπτικό μέτρο για 7 ημέρες μετά τη συμπλήρωση της θεραπείας με Paxlovid.
Ικανότητα οδήγησης και χειρισμός μηχανημάτων
Το Paxlovid αναμένεται να μην επηρεάζει την ικανότητα οδήγησης και χειρισμού μηχανημάτων.
Σχετικό SPC
Paxlovid 150 mg + 100 mg επικαλυμμένα με λεπτό υμένιο δισκία.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.
ΠΧΠ 2022: PAXLOVID Επικαλυμμένο με υμένιο δισκίο