Αντενδείξεις
- Υπερευαισθησία στις δραστικές ουσίες, στα παράγωγα της διυδροπυριδίνης ή σε κάποιο από τα έκδοχα που αναφέρονται στην παράγραφο 6.1.
- Σοβαρή ηπατική δυσλειτουργία, χολική κίρρωση ή χολόσταση.
- Η ταυτόχρονη χρήση του Exforge με προϊόντα που περιέχουν αλισκιρένη αντενδείκνυται σε ασθενείς με σακχαρώδη διαβήτη ή νεφρική δυσλειτουργία (GFR <60 ml/min/1,73m^2^) (βλ. παραγράφους 4.5 και 5.1).
- Δεύτερο και τρίτο τρίμηνο της κύησης (βλ. παραγράφους 4.4 και 4.6).
- Σοβαρή υπόταση.
- Σοκ (συμπεριλαμβανομένου του καρδιογενούς σοκ).
- Απόφραξη της οδούς εκροής της αριστεράς κοιλίας (π.χ. υπερτροφική αποφρακτική καρδιομυοπάθεια και αορτική στένωση υψηλού βαθμού).
- Αιμοδυναμικά ασταθή καρδιακή ανεπάρκεια μετά από οξύ έμφραγμα του μυοκαρδίου.
Προφυλάξεις και προειδοποιήσεις
Η ασφάλεια και η αποτελεσματικότητα της αμλοδιπίνης σε υπερτασική κρίση δεν έχει τεκμηριωθεί.
Κύηση
Οι Ανταγωνιστές των Υποδοχέων της Αγγειοτενσίνης ΙΙ (ΑΥΑΙΙ) δεν θα πρέπει να χορηγούνται κατά τη διάρκεια της κύησης. Σε περίπτωση που η συνέχιση της θεραπείας με ΑΥΑΙΙ θεωρείται αναγκαία, ασθενείς που σχεδιάζουν εγκυμοσύνη θα πρέπει να αλλάξουν αντιυπερτασική θεραπεία με κάποια άλλη η οποία να έχει αναγνωρισμένο προφίλ ασφαλείας για την χρήση του φαρμάκου κατά την κύηση. Εάν διαπιστωθεί εγκυμοσύνη, η θεραπεία με ΑΥΑΙΙ θα πρέπει να διακοπεί άμεσα και εάν απαιτείται, θα πρέπει να ξεκινήσει κάποια εναλλακτική θεραπεία (βλ. παραγράφους 4.3 και 4.6).
Ασθενείς με υποογκαιμία και/ή υπονατριαιμία
Σοβαρή υπόταση παρατηρήθηκε στο 0,4% των ασθενών με μη επιπλεγμένη υπέρταση που έλαβαν Exforge σε ελεγχόμενες με εικονικό φάρμακο μελέτες. Σε ασθενείς με ενεργοποιημένο σύστημα ρενίνης-αγγειοτενσίνης (όπως είναι οι ασθενείς με μειωμένο όγκο και/ή νάτριο που λαμβάνουν υψηλές δόσεις διουρητικών) που λαμβάνουν αναστολείς των υποδοχέων της αγγειοτενσίνης, ενδέχεται να εμφανιστεί συμπτωματική υπόταση. Πριν από τη χορήγηση του Exforge συνιστάται η διόρθωση αυτής της κατάστασης ή η στενή ιατρική επίβλεψη κατά την έναρξη της θεραπείας.
Εάν εμφανιστεί υπόταση από τη λήψη του Exforge, ο ασθενής θα πρέπει να τοποθετείται σε ύπτια θέση και, εάν είναι απαραίτητο, να του χορηγείται φυσιολογικός ορός σε ενδοφλέβια έγχυση. Η θεραπεία μπορεί να συνεχιστεί μόλις σταθεροποιηθεί η αρτηριακή πίεση του ασθενούς.
Υπερκαλιαιμία
Η ταυτόχρονη χρήση του φαρμάκου με συμπληρώματα καλίου, καλιοσυντηρητικά διουρητικά, υποκατάστατα άλατος που περιέχουν κάλιο, ή άλλα φαρμακευτικά προϊόντα που ενδέχεται να αυξήσουν τα επίπεδα καλίου (ηπαρίνη κ.λπ.) πρέπει να γίνεται με προσοχή και με συχνή παρακολούθηση των επιπέδων καλίου.
Στένωση των νεφρικών αρτηριών
Το Exforge θα πρέπει να χρησιμοποιείται με προσοχή για τη θεραπεία της υπέρτασης σε ασθενείς με μονόπλευρη ή αμφοτερόπλευρη στένωση των νεφρικών αρτηριών ή στένωση σε μονήρη νεφρό δεδομένου ότι η ουρία αίματος και η κρεατινίνη ορού μπορεί να αυξηθεί σε αυτούς τους ασθενείς.
Μεταμόσχευση νεφρού
Μέχρι σήμερα δεν υπάρχει εμπειρία σχετικά με την ασφάλεια της χρήσης του Exforge σε ασθενείς που υποβλήθηκαν πρόσφατα σε μεταμόσχευση νεφρού.
Ηπατική δυσλειτουργία
Η βαλσαρτάνη αποβάλλεται κυρίως αναλλοίωτη μέσω της χολής. Η ημιπερίοδος ζωής της αμλοδιπίνης παρατείνεται σε ασθενείς με διαταραχή της ηπατικής λειτουργίας και οι τιμές της AUC είναι υψηλότερες. Η συνιστώμενη δοσολογία στους ασθενείς αυτούς δεν έχει ακόμη καθοριστεί. Απαιτείται ιδιαίτερη προσοχή κατά τη χορήγηση του Exforge σε ασθενείς με ήπια έως μέτρια ηπατική δυσλειτουργία ή αποφρακτικές παθήσεις των χοληφόρων.
Σε ασθενείς με ήπια έως μέτρια ηπατική δυσλειτουργία χωρίς χολόσταση, η μέγιστη συνιστώμενη δόση είναι 80 mg βαλσαρτάνης.
Νεφρική δυσλειτουργία
Δεν απαιτείται τροποποίηση της δόσης του Exforge για τους ασθενείς με ήπια έως μέτρια νεφρική δυσλειτουργία (ΡΣΔ >30 ml/min/1,73m^2^). Στη μέτρια νεφρική δυσλειτουργία συνιστάται έλεγχος των επιπέδων του καλίου και της κρεατινίνης πλάσματος.
Πρωτοπαθής υπεραλδοστερονισμός
Οι ασθενείς με πρωτοπαθή υπεραλδοστερονισμό δεν πρέπει να λαμβάνουν θεραπεία με τον ανταγωνιστή των υποδοχέων της αγγειοτενσίνης ΙΙ βαλσαρτάνη, καθώς η πρωτοπαθής νόσος επηρεάζει το σύστημα ρενίνης-αγγειοτενσίνης.
Αγγειοοίδημα
Σε ασθενείς που έλαβαν θεραπεία με βαλσαρτάνη, έχει αναφερθεί αγγειοοίδημα,
συμπεριλαμβανομένου του οιδήματος του λάρυγγα και της γλωττίδας, προκαλώντας απόφραξη των αεραγωγών και/ή πρήξιμο στο πρόσωπο, τα χείλη, το φάρυγγα και/ή τη γλώσσα. Μερικοί από αυτούς τους ασθενείς παρουσίασαν αγγειοοίδημα στο παρελθόν με άλλα φαρμακευτικά προϊόντα, συμπεριλαμβανομένων και των αναστολέων ΜΕΑ. Το Exforge πρέπει να διακοπεί αμέσως σε ασθενείς που αναπτύσσουν αγγειοοίδημα και δεν πρέπει να χορηγείται εκ νέου.
Καρδιακή ανεπάρκεια/μετά από έμφραγμα του μυοκαρδίου
Ως αποτέλεσμα της αναστολής του συστήματος ρενίνης-αγγειοτενσίνης-αλδοστερόνης, είναι πιθανό να παρατηρηθούν μεταβολές της νεφρικής λειτουργίας σε ευαίσθητους ασθενείς. Σε ασθενείς με σοβαρή καρδιακή ανεπάρκεια των οποίων η νεφρική λειτουργία μπορεί να εξαρτάται από τη δραστηριότητα του συστήματος ρενίνης-αγγειοτενσίνης-αλδοστερόνης, η θεραπεία με αναστολείς του ΜΕΑ και ανταγωνιστές των υποδοχέων της αγγειοτενσίνης έχει συνδεθεί με ολιγουρία και/ή προοδευτική αζωθαιμία και (σπάνια) με οξεία νεφρική ανεπάρκεια και/ή θάνατο. Παρόμοιες εκβάσεις έχουν αναφερθεί με τη βαλσαρτάνη. Η αξιολόγηση των ασθενών με καρδιακή ανεπάρκεια ή μετά από έμφραγμα του μυοκαρδίου πρέπει πάντα να περιλαμβάνει εκτίμηση της νεφρικής λειτουργίας.
Σε μια μακροχρόνια, ελεγχόμενη με εικονικό φάρμακο μελέτη (PRAISE-2) της χρήσης της αμλοδιπίνης σε ασθενείς με καρδιακή ανεπάρκεια μη ισχαιμικής αιτιολογίας κατηγορίας ΙΙΙ και ΙV σύμφωνα με την ταξινόμηση της NYHA (Καρδιολογική Εταιρεία Νέας Υόρκης), η αμλοδιπίνη συνδέθηκε με αυξημένο αριθμό αναφορών πνευμονικού οιδήματος παρά τη μη σημαντική διαφορά στην επίπτωση της επιδείνωσης της καρδιακής ανεπάρκειας σε σύγκριση με το εικονικό φάρμακο.
Οι αναστολείς διαύλων ασβεστίου, συμπεριλαμβανομένης της αμλοδιπίνης, θα πρέπει να χορηγούνται με προσοχή σε ασθενείς με συμφορητική καρδιακή ανεπάρκεια, καθώς μπορεί να αυξήσουν τον κίνδυνο μελλοντικών καρδιαγγειακών συμβαμάτων και θνητότητας.
Στένωση της αορτής και της μιτροειδούς βαλβίδας
Όπως και με όλα τα αγγειοδιασταλτικά, ενδείκνυται ιδιαίτερη προσοχή σε ασθενείς που πάσχουν από στένωση της μιτροειδούς βαλβίδας ή σημαντική αορτική στένωση που δεν είναι υψηλού βαθμού.
Διπλός αποκλεισμός του συστήματος ρενίνης-αγγειοτενσίνης-αλδοστερόνης (ΣΡΑΑ)
Υπάρχουν αποδείξεις ότι η ταυτόχρονη χρήση αναστολέων ΜΕΑ, ΑΥΑΙΙ ή αλισκιρένηςαυξάνει τον κίνδυνο υπότασης, υπερκαλιαιμίας και μειωμένης νεφρικής λειτουργίας (περιλαμβανομένης της οξείας νεφρικής ανεπάρκειας). Ως εκ τούτου, διπλός αποκλεισμός του συστήματος ρενίνης-αγγειοτενσίνης-αλδοστερόνης (ΣΡΑΑ) μέσω της συνδυασμένης χρήσης αναστολέων ΜΕΑ, ΑΥΑΙΙ ή αλισκιρένης δεν συνιστάται (βλ. παραγράφους 4.5 και 5.1).
Εάν η θεραπεία διπλού αποκλεισμού θεωρείται απολύτως απαραίτητη, αυτό θα πρέπει να λάβει χώρα μόνο κάτω από την επίβλεψη ειδικού και με συχνή στενή παρακολούθηση της νεφρικής λειτουργίας, των ηλεκτρολυτών και της αρτηριακής πίεσης. Οι αναστολείς ΜΕΑ και οι ΑΥΑΙΙ δεν θα πρέπει να χρησιμοποιούνται ταυτόχρονα σε ασθενείς με διαβητική νεφροπάθεια.
Το Exforge δεν έχει μελετηθεί σε άλλο πληθυσμό ασθενών εκτός από υπερτασικούς.
Ασυμβατότητες
Δεν εφαρμόζεται.
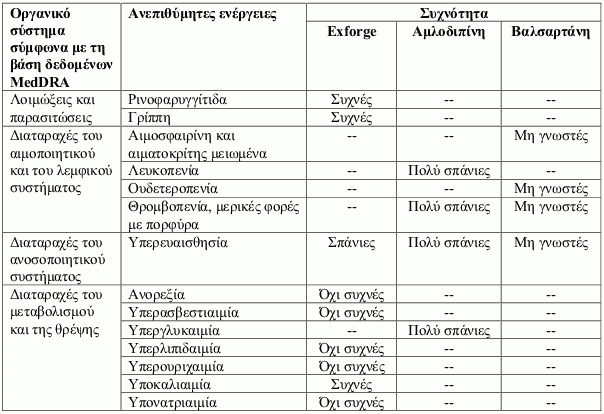
Ανεπιθύμητες ενέργειες
Περίληψη του προφίλ ασφαλείας
Η ασφάλεια του Exforge έχει αξιολογηθεί σε πέντε ελεγχόμενες κλινικές μελέτες με 5.175 ασθενείς, από τους οποίους οι 2.613 έλαβαν βαλσαρτάνη σε συνδυασμό με αμλοδιπίνη. Οι ακόλουθες ανεπιθύμητες ενέργειες βρέθηκαν να είναι οι πιο συχνά εμφανιζόμενες ή οι πιο σημαντικές ή σοβαρές: ρινοφαρυγγίτιδα, γρίπη, υπερευαισθησία, πονοκέφαλος, συγκοπή, ορθοστατική υπόταση, οίδημα, οίδημα με εντύπωμα, οίδημα προσώπου, περιφερικό οίδημα, κόπωση, ερυθρότητα, εξασθένιση και έξαψη.
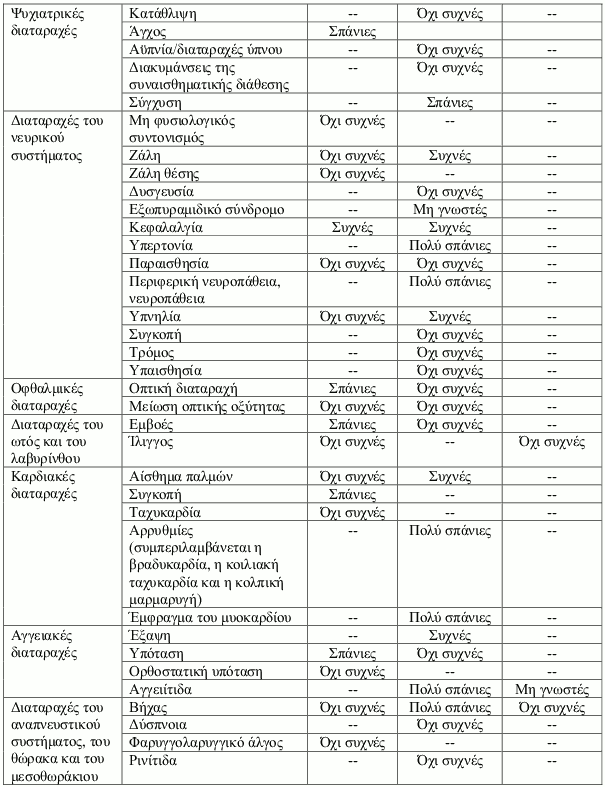
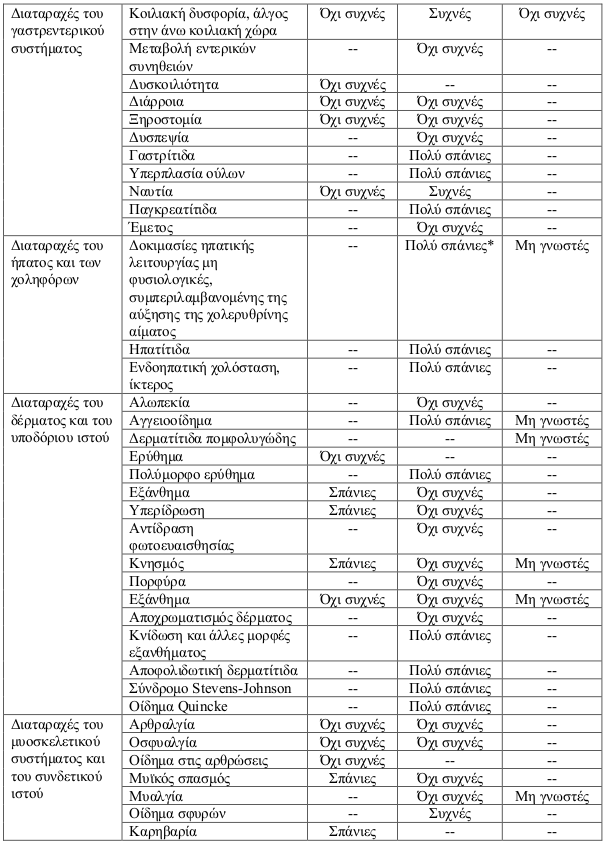
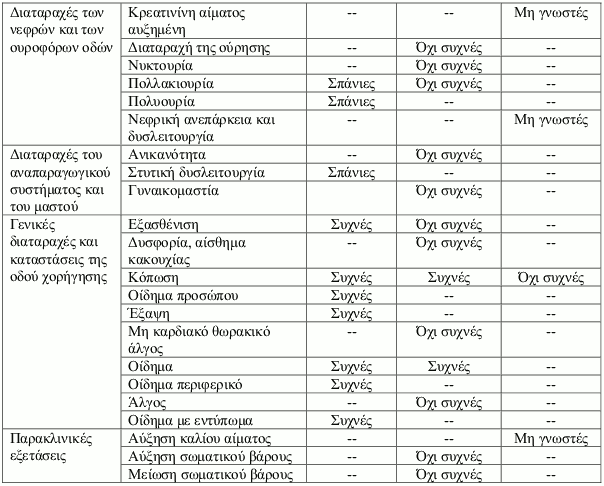
Κατάλογος ανεπιθύμητων ενεργειών σε πίνακα
Οι ανεπιθύμητες αντιδράσεις έχουν ταξινομηθεί σε κατηγορίες ανάλογα με τη συχνότητά τους χρησιμοποιώντας τον παρακάτω κανόνα: πολύ συχνές (≥1/10), συχνές (≥1/100 έως <1/10), όχι συχνές (≥1/1.000 έως <1/100), σπάνιες (≥1/10.000 έως <1/1.000), πολύ σπάνιες (<1/10.000), μη γνωστές (δεν μπορούν να εκτιμηθούν με βάση τα διαθέσιμα δεδομένα).
* Κυρίως συμβατά με χολόσταση
Επιπρόσθετες πληροφορίες σχετικά με το συνδυασμό
Περιφερικό οίδημα, μια αναγνωρισμένη ανεπιθύμητη ενέργεια της αμλοδιπίνης, γενικά παρατηρήθηκε σε μικρότερη συχνότητα εμφάνισης σε ασθενείς που έλαβαν συνδυασμό αμλοδιπίνης/βαλσαρτάνης από ότι σε αυτούς που έλαβαν μόνο αμλοδιπίνη. Σε διπλά-τυφλές, ελεγχόμενες κλινικές δοκιμές, η συχνότητα εμφάνισης περιφερικού οιδήματος σε σχέση με τη δοσολογία ήταν η ακόλουθη:
| % ασθενών που είχαν περιφερικό οίδημα | Βαλσαρτάνη (mg) | |||||
|---|---|---|---|---|---|---|
| 0 | 40 | 80 | 160 | 320 | ||
| Αμλοδιπίνη (mg) | 0 | 3,0 | 5,5 | 2,4 | 1,6 | 0,9 |
| 2,5 | 8,0 | 2,3 | 5,4 | 2,4 | 3,9 | |
| 5 | 3,1 | 4,8 | 2,3 | 2,1 | 2,4 | |
| 10 | 10,3 | ΝΑ | ΝΑ | 9,0 | 9,5 | |
Η μέση συχνότητα εμφάνισης περιφερικού οιδήματος ομοιόμορφα σταθμισμένη σε όλο το εύρος των δόσεων ήταν 5,1% με το συνδυασμό αμλοδιπίνης/βαλσαρτάνης.
Επιπρόσθετες πληροφορίες σχετικά με τα μεμονωμένα συστατικά
Οι ανεπιθύμητες ενέργειες του φαρμάκου που αναφέρθηκαν παραπάνω για το κάθε μεμονωμένο συστατικό (αμλοδιπίνη ή βαλσαρτάνη) μπορεί να αποτελέσουν πιθανές ανεπιθύμητες ενέργειές του Exforge επίσης, έστω και εάν δεν παρατηρήθηκαν σε κλινικές δοκιμές ή κατά τη διάρκεια της κυκλοφορίας του.
Αμλοδιπίνη
Συχνές: Υπνηλία, ζάλη, αίσθημα παλμών, κοιλιακό άλγος, ναυτία, οίδημα σφυρών.
Όχι συχνές: Αϋπνία, μεταβολές της διάθεσης (συμπεριλαμβανομένου του άγχους), κατάθλιψη, τρόμος, δυσγευσία, συγκοπή, υπαισθησία, οπτικές διαταραχές (συμπεριλαμβανομένης της διπλωπίας), εμβοές, υπόταση, δύσπνοια, ρινίτιδα, έμετος, δυσπεψία, αλωπεκία, πορφύρα, δυσχρωματισμός δέρματος, αυξημένη εφίδρωση, κνησμός, εξάνθημα, μυαλγία, μυϊκές κράμπες, άλγος, διαταραχή ούρησης, αυξημένη συχνότητα ούρησης, ανικανότητα, γυναικομαστία, θωρακικό άλγος, εξασθένιση, αύξηση σωματικού βάρους, μείωση σωματικού βάρους.
Σπάνιες: Σύγχυση.
Πολύ σπάνιες: Λευκοπενία, θρομβοπενία, αλλεργικές αντιδράσεις, υπεργλυκαιμία, υπερτονία, περιφερική νευροπάθεια, έμφραγμα του μυοκαρδίου, αρρυθμία (συμπεριλαμβανομένων της βραδυκαρδίας, της κοιλιακής ταχυκαρδίας και της κολπικής μαρμαρυγής), αγγειίτιδα, παγκρεατίτιδα, γαστρίτιδα, υπερπλασία ούλων, ηπατίτιδα, ίκτερος, ηπατικά ένζυμα αυξημένα*, αγγειοοίδημα, πολύμορφο ερύθημα, κνίδωση, αποφολιδωτική δερματίτιδα, σύνδρομο Stevens Johnson, οίδημα Quincke, φωτοευαισθησία.
* κυρίως συμβατά με χολόσταση
Σε εξαιρετικές περιπτώσεις έχει αναφερθεί εξωπυραμιδικό σύνδρομο.
Βαλσαρτάνη
Μη γνωστές: Μείωση της αιμοσφαιρίνης, μείωση του αιμοτοκρίτη, ουδετεροπενία, θρομβοκυτοπενία, αύξηση του καλίου στον ορό, αύξηση των τιμών της ηπατικής λειτουργίας συμπεριλαμβανομένης της αύξησης της χολερυθρίνης ορού, νεφρική ανεπάρκεια και δυσλειτουργία, αύξηση της κρεατινίνης ορού, αγγειοοίδημα, μυαλγία, αγγειίτιδα, υπερευαισθησία συμπεριλαμβανομένης της ορονοσίας.
Αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών
Η αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών μετά από τη χορήγηση άδειας κυκλοφορίας του φαρμακευτικού προϊόντος είναι σημαντική. Επιτρέπει τη συνεχή παρακολούθηση της σχέσης οφέλους-κινδύνου του φαρμακευτικού προϊόντος. Ζητείται από τους επαγγελματίες του τομέα της υγειονομικής περίθαλψης να αναφέρουν οποιεσδήποτε πιθανολογούμενες ανεπιθύμητες ενέργειες μέσω του εθνικού συστήματος αναφοράς που αναγράφεται στο Παράρτημα V.
Αλληλεπιδράσεις με άλλα φάρμακα ή ουσίες
Συχνές αλληλεπιδράσεις με το συνδυασμό
Δεν έχουν πραγματοποιηθεί μελέτες αλληλεπιδράσεων του Exforge με άλλα φαρμακευτικά προϊόντα.
Να λαμβάνονται υπόψη με ταυτόχρονη χρήση
Άλλοι αντιυπερτασικοί παράγοντες:
Οι συχνά χρησιμοποιούμενοι αντιυπερτασικοί παράγοντες (π.χ. άλφα αποκλειστές, διουρητικά) και άλλα φαρμακευτικά προϊόντα τα οποία μπορεί να προκαλέσουν ανεπιθύμητα υποτασικά αποτελέσματα (π.χ. τρικυκλικά αντικαταθλιπτικά, άλφα αποκλειστές για τη θεραπεία της καλοήθους υπερπλασίας του προστάτη) μπορεί να αυξήσουν την αντιυπερτασική δράση του συνδυασμού.
Αλληλεπιδράσεις που συνδέονται με την αμλοδιπίνη
Δεν συνιστάται η ταυτόχρονη χρήση
Γκρέιπφρουτ ή χυμός γκρέιπφρουτ:
Δεν συνιστάται η χορήγηση της αμλοδιπίνης με γκρέιπφρουτ ή χυμό γκρέιπφρουτ καθώς μπορεί να αυξηθεί η βιοδιαθεσιμότητα σε ορισμένους ασθενείς, με αποτέλεσμα την αύξηση του αντιυπερτασικού αποτελέσματος.
Απαιτείται προσοχή κατά την ταυτόχρονη χρήση
Αναστολείς του CYP3A4:
Η ταυτόχρονη χρήση της αμλοδιπίνης με ισχυρούς ή μέτριους αναστολείς του CYP3A4 (αναστολείς πρωτεάσης, αντιμυκητιασικά της ομάδας των αζολών, μακρολίδια όπως ερυθρομυκίνη ή κλαριθρομυκίνη, βεραπαμίλη ή διλτιαζέμη) μπορεί να οδηγήσει σε σημαντική αύξηση της έκθεσης στην αμλοδιπίνη. Η κλινική μετάφραση αυτών των φαρμακοκινητικών διαφοροποιήσεων ενδέχεται να είναι εντονότερη στους ηλικιωμένους. Συνεπώς, μπορεί να απαιτείται κλινική παρακολούθηση και προσαρμογή της δοσολογίας.
Επαγωγείς του CYP3A4 (αντιεπιληπτικά [π.χ. καρβαμαζεπίνη, φαινοβαρβιτάλη, φαινυτοΐνη, φωσφαινυτοΐνη, πριμιδόνη], ριφαμπικίνη, υπερικόν το διάτρητον):
Δεν υπάρχουν διαθέσιμα στοιχεία για την επίδραση των επαγωγέων του CYP3A4 στην αμλοδιπίνη. Η συγχορήγηση των επαγωγέων του CYP3A4 [π.χ. ριφαμπικίνη, υπερικόν το διάτρητον (βαλσαμόχορτο)] μπορεί να οδηγήσει σε μειωμένη συγκέντρωση της αμλοδιπίνης στο πλάσμα. Η αμλοδιπίνη πρέπει να χορηγείται με προσοχή όταν συγχορηγείται με επαγωγείς του CYP3A4.
Σιμβαστατίνη:
Η συγχορήγηση πολλαπλών δόσεων των 10 mg αμλοδιπίνης με 80 mg σιμβαστατίνης οδήγησε σε αύξηση 77% της έκθεσης στη σιμβαστατίνη σε σύγκριση με τη σιμβαστατίνη μόνη της. Συνιστάται να περιοριστεί η δόση της σιμβαστατίνης σε 20 mg ημερησίως σε ασθενείς με αμλοδιπίνη.
Δαντρολένιο (έγχυση):
Μετά από χορήγηση βεραπαμίλης και δαντρολενίου ενδοφλεβίως σε ζώα, παρατηρήθηκε θανατηφόρος κοιλιακή μαρμαρυγή και καρδιογενής καταπληξία σχετιζόμενη με υπερκαλιαιμία. Λόγω του κινδύνου εμφάνισης υπερκαλιαιμίας, συνιστάται η αποφυγή συγχορήγησης αναστολέων διαύλων του ασβεστίου, όπως η αμλοδιπίνη, σε ασθενείς επιρρεπείς σε κακοήθη υπερθερμία και στην αντιμετώπιση της κακοήθους υπερθερμίας.
Να λαμβάνονται υπόψη με ταυτόχρονη χρήση
Άλλα:
Σε κλινικές μελέτες αλληλεπίδρασης, η αμλοδιπίνη δεν επηρέασε τη φαρμακοκινητική της ατορβαστατίνης, της διγοξίνης, της βαρφαρίνης ή της κυκλοσπορίνης.
Αλληλεπιδράσεις που συνδέονται με τη βαλσαρτάνη
Η ταυτόχρονη χρήση δεν συνιστάται
Λίθιο:
Έχουν αναφερθεί αναστρέψιμες αυξήσεις των συγκεντρώσεων του λιθίου στον ορό καθώς και περιστατικά τοξικότητας κατά τη διάρκεια ταυτόχρονης χορήγησης λιθίου με αναστολείς του μετατρεπτικού ενζύμου της αγγειοτενσίνης ή ανταγωνιστές των υποδοχέων της αγγειοτενσίνης ΙΙ, συμπεριλαμβανομένης της βαλσαρτάνης. Επομένως, συνιστάται προσεκτική παρακολούθηση των επιπέδων του λιθίου στον ορό κατά την συγχορήγηση. Επίσης, εάν χρησιμοποιείται και διουρητικό, ο κίνδυνος εμφάνισης τοξικότητας λόγω του λιθίου πιθανά να αυξηθεί περαιτέρω με το Exforge.
Καλιοσυντηρητικά διουρητικά, συμπληρώματα καλίου, υποκατάστατα άλατος που περιέχουν κάλιο και άλλες ουσίες που μπορεί να αυξήσουν τα επίπεδα καλίου.
Εάν σε συνδυασμό με τη βαλσαρτάνη, πρόκειται να συνταγογραφηθεί φαρμακευτικό προϊόν που επηρεάζει τα επίπεδα καλίου, συνιστάται η παρακολούθηση των επιπέδων του καλίου στο πλάσμα.
Απαιτείται προσοχή κατά την ταυτόχρονη χρήση
Μη στεροειδή αντιφλεγμονώδη φάρμακα (ΜΣΑΦ), περιλαμβανομένων εκλεκτικών αναστολέων COX-2, ακετυλοσαλικυλικού οξέος (>3 g/ημέρα) και μη εκλεκτικών ΜΣΑΦ:
Όταν οι ανταγωνιστές της αγγειοτενσίνης ΙΙ χορηγούνται ταυτόχρονα με ΜΣΑΦ, μπορεί να παρατηρηθεί εξασθένηση της αντιυπερτασικής δράσης. Επιπλέον, η ταυτόχρονη χρήση ανταγωνιστών της αγγειοτενσίνης ΙΙ και ΜΣΑΦ ενδέχεται να οδηγήσει σε αυξημένο κίνδυνο επιδείνωσης της νεφρικής λειτουργίας και σε αύξηση του καλίου ορού. Επομένως, συνιστάται η παρακολούθηση της νεφρικής λειτουργίας κατά την έναρξη της θεραπείας καθώς και η επαρκής ενυδάτωση του ασθενούς.
Αναστολείς του μεταφορέα πρόσληψης (ριφαμπικίνη, κυκλοσπορίνη) ή μεταφορέα εκροής (ριτοναβίρη):
Τα αποτελέσματα μιας μελέτης in vitro με ιστούς ανθρώπινου ήπατος δείχνουν ότι η βαλσαρτάνη αποτελεί υπόστρωμα του μεταφορέα ηπατικής πρόσληψης OATP1B1 και του μεταφορέα της ηπατικής εκροής MRP2. Η συγχορήγηση των αναστολέων του μεταφορέα πρόσληψης (ριφαμπικίνη, κυκλοσπορίνη) ή του μεταφορέα εκροής (ριτοναβίρη) μπορεί να αυξήσει την συστηματική έκθεση στη βαλσαρτάνη.
Διπλός αποκλεισμός του ΣΡΑΑ με ΑΥΑ, αναστολείς ΜΕΑ ή αλισκιρένη:
Τα δεδομένα από κλινικές μελέτες έχουν δείξει ότι ο διπλός αποκλεισμός του συστήματος ρενίνης-αγγειοτενσίνης-αλδοστερόνης (ΣΡΑΑ) μέσω της συνδυασμένης χρήσης αναστολέων ΜΕΑ, ΑΥΑΙΙ ή αλισκιρένης συσχετίζεται με υψηλότερη συχνότητα ανεπιθυμήτων συμβάντων όπως η υπόταση, η υπερκαλιαιμία και η μειωμένη νεφρική λειτουργία (περιλαμβανομένης της οξείας νεφρικής ανεπάρκειας) σε σύγκριση με τη χρήση ενός μόνου παράγοντα που δρα στο σύστημα ρενίνης-αγγειοτενσίνης-αλδοστερόνης (ΣΡΑΑ) (βλ. παραγράφους 4.3, 4.4 και 5.1).
Άλλα:
Σε μονοθεραπεία με βαλσαρτάνη, δεν έχουν διαπιστωθεί αλληλεπιδράσεις κλινικής σημασίας με τις παρακάτω ουσίες: σιμετιδίνη, βαρφαρίνη, φουροσεμίδη, διγοξίνη, ατενολόλη, ινδομεθακίνη, υδροχλωροθειαζίδη, αμλοδιπίνη, γλιβενκλαμίδη.
Κύηση
Αμλοδιπίνη
Η ασφάλεια της αμλοδιπίνης κατά την διάρκεια της κύησης δεν έχει τεκμηριωθεί. Σε μελέτες που πραγματοποιήθηκαν σε ζώα, παρατηρήθηκε αναπαραγωγική τοξικότητα σε υψηλές δόσεις (βλ. παράγραφο 5.3). Η χρήση αμλοδιπίνης κατά τη διάρκεια της εγκυμοσύνης συνιστάται μόνο όταν δεν υπάρχει άλλη ασφαλέστερη εναλλακτική και όταν η ίδια η ασθένεια φέρει μεγαλύτερο κίνδυνο για την μητέρα και το έμβρυο.
Βαλσαρτάνη
Η χρήση των Ανταγωνιστών των Υποδοχέων της Αγγειοτενσίνης ΙΙ (ΑΥΑΙΙ) δεν συνιστάται κατά τη διάρκεια του πρώτου τριμήνου της εγκυμοσύνης (βλ. παράγραφο 4.4). Η χρήση των ΑΥΑΙΙ αντενδείκνυται κατά τη διάρκεια του δεύτερου και τρίτου τριμήνου της εγκυμοσύνης (βλ. παραγράφους 4.3 και 4.4).
Τα επιδημιολογικά στοιχεία που υπάρχουν σχετικά με τον κίνδυνο τερατογένεσης μετά από χρήση αναστολέων ΜΕΑ κατά τη διάρκεια του πρώτου τριμήνου της εγκυμοσύνης δεν έχουν καταλήξει σε σαφές συμπέρασμα. Ωστόσο δεν μπορεί να αποκλειστεί μια μικρή αύξηση εμφάνισης κινδύνου. Παρόλο που δεν υπάρχουν ελεγχόμενα επιδημιολογικά στοιχεία για τον κίνδυνο με τη χρήση Ανταγωνιστών των Υποδοχέων της Αγγειοτενσίνης ΙΙ (ΑΥΑΙΙ), μπορεί να υπάρχει παρόμοιος κίνδυνος για αυτή την κατηγορία φαρμάκων. Σε περίπτωση που η συνέχιση της θεραπείας με ΑΥΑΙΙ θεωρείται αναγκαία, ασθενείς που σχεδιάζουν εγκυμοσύνη θα πρέπει να αλλάξουν αντιυπερτασική θεραπεία με κάποια άλλη η οποία να έχει αναγνωρισμένο προφίλ ασφαλείας για την χρήση του φαρμάκου κατά την κύηση. Εάν διαπιστωθεί εγκυμοσύνη, η θεραπεία με ΑΥΑΙΙ θα πρέπει να διακοπεί άμεσα και εάν απαιτείται, θα πρέπει να ξεκινήσει κάποια εναλλακτική θεραπεία.
Η έκθεση σε θεραπεία με ΑΥΑΙΙ κατά το δεύτερο και τρίτο τρίμηνο είναι γνωστό ότι προκαλεί εμβρυοτοξικότητα στον άνθρωπο (μειωμένη νεφρική λειτουργία, ολιγοϋδράμνιο, καθυστέρηση οστεοποίησης κρανίου) και βρεφική τοξικότητα (νεφρική ανεπάρκεια, υπόταση, υπερκαλιαιμία) (βλ. παράγραφο 5.3).
Εάν η έκθεση σε ΑΥΑΙΙ έλαβε χώρα μετά το δεύτερο τρίμηνο της εγκυμοσύνης, συνιστάται έλεγχος της νεφρικής λειτουργίας και του κρανίου με υπερήχους.
Νεογνά των οποίων οι μητέρες εκτέθηκαν σε ΑΥΑΙΙ θα πρέπει να παρακολουθούνται στενά για υπόταση (βλ παραγράφους 4.3 και 4.4).
Γαλουχία
Δεν υπάρχουν διαθέσιμα στοιχεία σχετικά με τη χρήση του Exforge κατά τη διάρκεια της γαλουχίας, επομένως το Exforge δεν συνιστάται σε αυτή την περίοδο και προτείνονται εναλλακτικές θεραπείες με εγκατεστημένο προφίλ ασφάλειας, ιδιαίτερα κατά το θηλασμό νεογέννητου ή πρόωρου νεογνού.
Ικανότητα οδήγησης και χειρισμός μηχανημάτων
Οι ασθενείς που λαμβάνουν Exforge και οδηγούν οχήματα ή χειρίζονται μηχανές πρέπει να λαμβάνουν υπόψη ότι μπορεί να εμφανιστεί ζάλη ή κόπωση περιστασιακά.
Η αμλοδιπίνη μπορεί να έχει μικρή ή μέτρια επίδραση στην ικανότητα οδήγησης και χειρισμού μηχανών. Εάν οι ασθενείς που λαμβάνουν αμλοδιπίνη υποφέρουν από ζάλη, κεφαλαλγία, κόπωση ή ναυτία, η ικανότητα αντίδρασης μπορεί να έχει επηρεασθεί.
Σχετικό SPC
Exforge 5 mg/80 mg επικαλυμμένα με λεπτό υμένιο δισκία.
Exforge 5 mg/160 mg επικαλυμμένα με λεπτό υμένιο δισκία.
Exforge 10 mg/160 mg επικαλυμμένα με λεπτό υμένιο δισκία.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.