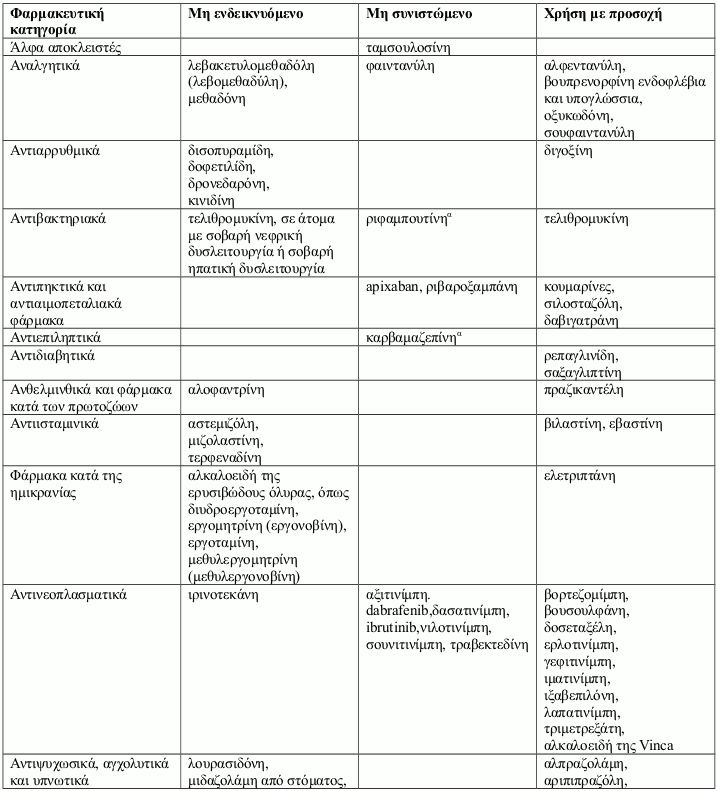
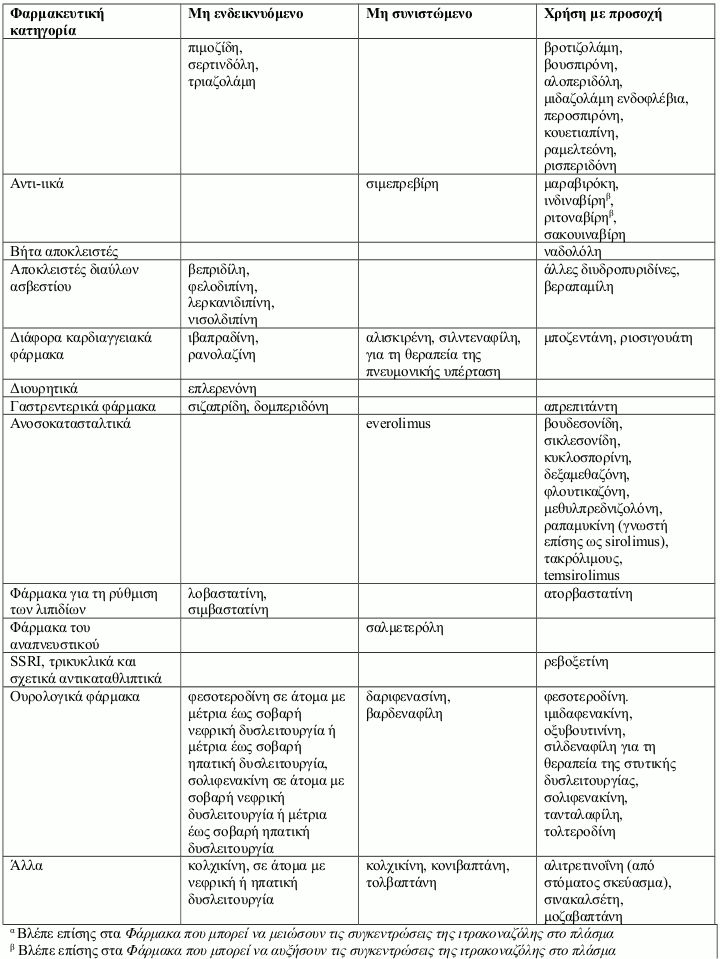
Αντενδείξεις
Το πόσιμο διάλυμα SPORANOX αντενδείκνυται σε ασθενείς με γνωστή υπερευαισθησία στην ιτρακοναζόλη ή σε κάποιο από τα έκδοχα.
Η συγχορήγηση ενός αριθμού υποστρωμάτων του CYP3A4 αντενδείκνυται με το πόσιμο διάλυμα SPORANOX. Αυξημένες συγκεντρώσεις αυτών των φαρμάκων στο πλάσμα, λόγω της συγχορήγησης με ιτρακοναζόλη, μπορούν να αυξήσουν ή να παρατείνουν τόσο τις θεραπευτικές επιδράσεις όσο και τις ανεπιθύμητες ενέργειες σε τέτοιο βαθμό που θα μπορούσαν να υπάρξουν δυνητικά σοβαρές καταστάσεις. Για παράδειγμα, οι αυξημένες συγκεντρώσεις στο πλάσμα ορισμένων από τα φάρμακα αυτά μπορούν να οδηγήσουν σε παράταση του διαστήματος QT και κοιλιακές ταχυαρρυθμίες συμπεριλαμβανομένης της εμφάνισης κοιλιακής ταχυκαρδίας δίκην ριπιδίου (torsade de pointes), μίας δυνητικά θανατηφόρου αρρυθμίας. Συγκεκριμένα παραδείγματα παρατίθενται στην παράγραφο 4.5.
Το πόσιμο διάλυμα SPΟRANOX δεν πρέπει να χορηγείται σε ασθενείς με ένδειξη κοιλιακής δυσλειτουργίας όπως συμφορητική καρδιακή ανεπάρκεια (ΣΚΑ) ή ιστορικό ΣΚΑ με εξαίρεση τη θεραπεία απειλητικών για τη ζωή ή άλλων σοβαρών λοιμώξεων. (Βλέπε παράγραφο 4.4).
Το πόσιμο διάλυμα SPORANOX δεν πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης (εκτός από περιπτώσεις που είναι απειλητικές για τη ζωή) (Βλέπε παράγραφο 4.6).
Οι γυναίκες που βρίσκονται σε αναπαραγωγική ηλικία και χρησιμοποιούν το πόσιμο διάλυμα SPORANOX πρέπει να λαμβάνουν αντισυλληπτικές προφυλάξεις. Η αποτελεσματική αντισύλληψη πρέπει να συνεχίζεται ως την εμμηνορρυσία που θα εμφανισθεί μετά το τέλος της θεραπείας με πόσιμο διάλυμα SPORANOX.
Προφυλάξεις και προειδοποιήσεις
Καρδιακές επιδράσεις
Σε μία μελέτη του SPORANOX I.V. με υγιείς εθελοντές παρατηρήθηκε παροδική ασυμπτωματική μείωση του κλάσματος εξώθησης της αριστερής κοιλίας, η οποία υποχώρησε πριν από την επόμενη έγχυση. Η κλινική σημασία αυτών των ευρημάτων με τα από στόματος σκευάσματα δεν είναι γνωστή.
Έχει αποδειχθεί ότι η ιτρακοναζόλη έχει αρνητική ινότροπο δράση και το SPORANOX έχει συσχετισθεί με αναφορές συμφορητικής καρδιακής ανεπάρκειας. Η καρδιακή ανεπάρκεια αναφέρθηκε πιο συχνά στις αυθόρμητες αναφορές με συνολική ημερήσια δόση 400 mg συγκριτικά με τις περιπτώσεις με χαμηλότερες συνολικές ημερήσιες δόσεις, υποδεικνύοντας ότι ο κίνδυνος εμφάνισης καρδιακής ανεπάρκειας μπορεί να αυξηθεί με τη συνολική ημερήσια δόση της ιτρακοναζόλης.
To SPORANOX δεν πρέπει να χρησιμοποιείται σε ασθενείς με συμφορητική καρδιακή ανεπάρκεια ή με ιστορικό συμφορητικής καρδιακής ανεπάρκειας εκτός εάν το όφελος υπερτερεί σαφώς του κινδύνου. Αυτή η εξατομικευμένη αξιολόγηση οφέλους/κινδύνου πρέπει να λαμβάνει υπόψη παράγοντες όπως η βαρύτητα της ένδειξης, το δοσολογικό σχήμα (π.χ. τη συνολική ημερήσια δόση) και τους ατομικούς παράγοντες κινδύνου για συμφορητική καρδιακή ανεπάρκεια. Σε αυτούς τους παράγοντες κινδύνου περιλαμβάνονται καρδιακή νόσος, όπως ισχαιμική νόσος και βαλβιδοπάθεια, σημαντική πνευμονοπάθεια, όπως χρόνια αποφρακτική πνευμονοπάθεια και νεφρική ανεπάρκεια, καθώς και άλλες οιδηματώδεις διαταραχές. Κατά τη διάρκεια της θεραπείας αυτοί οι ασθενείς θα πρέπει να ενημερώνονται για τα σημεία και συμπτώματα της συμφορητικής καρδιακής ανεπάρκειας, θα πρέπει να αντιμετωπίζονται με προσοχή και θα πρέπει να παρακολουθούνται για σημεία και συμπτώματα συμφορητικής καρδιακής ανεπάρκειας. Εάν αυτά τα σημεία ή συμπτώματα εμφανιστούν κατά τη διάρκεια της θεραπείας, το SPORANOX πρέπει να διακόπτεται.
Οι αποκλειστές διαύλων ασβεστίου μπορεί να έχουν αρνητική ινότροπο δράση, η οποία μπορεί να είναι προσθετική σε αυτή της ιτρακοναζόλης. Επιπρόσθετα, η ιτρακοναζόλη μπορεί να αναστείλει το μεταβολισμό των αναστολέων διαύλων ασβεστίου. Επομένως χρειάζεται προσοχή κατά τη συγχορήγηση ιτρακοναζόλης και αναστολέων διαύλων ασβεστίου, εξαιτίας του αυξημένου κινδύνου για εμφάνιση ΣΚΑ.
Δυνητικές αλληλεπιδράσεις
Η συγχορήγηση συγκεκριμένων φαρμάκων με την ιτρακοναζόλη μπορεί να οδηγήσει σε μεταβολές της αποτελεσματικότητας της ιτρακοναζόλης και/ή του συγχορηγούμενου φαρμάκου, απειλητικές για τη ζωή ανεπιθύμητες ενέργειες και/ή αιφνίδιο θάνατο. Τα φάρμακα που αντενδείκνυνται, δεν συνιστώνται ή συνιστώνται με προσοχή σε συνδυασμό με την ιτρακοναζόλη παρουσιάζονται στην παράγραφο 4.5.
Διασταυρούμενη υπερευαισθησία
Οι πληροφορίες σχετικά με τη διασταυρούμενη υπερευαισθησία μεταξύ της ιτρακοναζόλης και άλλων αντιμυκητιασικών παραγόντων της ομάδας των αζολών είναι περιορισμένες. Πρέπει να δίνεται προσοχή κατά τη συνταγογράφηση του πόσιμου διαλύματος SPORANOX σε ασθενείς με υπερευαισθησία σε άλλες αζόλες.
Νευροπάθεια
Αν εμφανισθεί νευροπάθεια που μπορεί να αποδίδεται στη χρήση του πόσιμου διαλύματος SPORANOX η θεραπεία θα πρέπει να διακόπτεται.
Απώλεια ακοής
Έχει αναφερθεί παροδική ή μόνιμη απώλεια ακοής σε ασθενείς που λαμβάνουν θεραπεία με ιτρακοναζόλη. Αρκετές από αυτές τις αναφορές περιελάμβαναν ταυτόχρονη χορήγηση κινιδίνης, η οποία αντενδείκνυται (βλέπε παραγράφους 4.3 Αντενδείξεις και 4.5 Αλληλεπιδράσεις με άλλα φαρμακευτικά προϊόντα και άλλες μορφές αλληλεπίδρασης, Φάρμακα των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να αυξηθούν από την ιτρακοναζόλη). Η απώλεια ακοής συνήθως υποχωρεί με τη διακοπή της θεραπείας, αλλά μπορεί να επιμείνει σε ορισμένους ασθενείς.
Διασταυρούμενη αντοχή
Στη συστηματική καντιντίαση, εάν υπάρχει υποψία ανθεκτικών στη φλουκοναζόλη στελεχών Candida, δεν μπορεί να υποτεθεί ότι αυτά είναι ευαίσθητα στην ιτρακοναζόλη. Ως εκ τούτου συνιστάται ο έλεγχος της ευαισθησίας των στελεχών πριν την έναρξη της θεραπείας με ιτρακοναζόλη.
Μετάβαση σε διαφορετική μορφή σκευάσματος SPORANOX
Τα καψάκια SPORANOX και το πόσιμο διάλυμα SPORANOX δεν συνιστάται να χρησιμοποιούνται κατ εναλλαγή. Αυτό συμβαίνει διότι κατά τη χορήγηση της ίδιας δόσης φαρμάκου η έκθεση στο φάρμακο με το πόσιμο διάλυμα είναι μεγαλύτερη σε σύγκριση με τα καψάκια.
Ηπατικές επιδράσεις
Με τη χρήση του SPORANOX, έχουν εμφανισθεί πολύ σπάνιες περιπτώσεις σοβαρής ηπατοτοξικότητας, συμπεριλαμβανομένων ορισμένων περιπτώσεων θανατηφόρας οξείας ηπατικής ανεπάρκειας. Οι περισσότερες από τις περιπτώσεις αυτές περιλαμβάνουν ασθενείς με προϋπάρχουσα ηπατική νόσο, που αντιμετωπίστηκαν για συστηματικές ενδείξεις, είχαν άλλες σημαντικές ιατρικές παθήσεις ή/και λάμβαναν άλλα ηπατοτοξικά φάρμακα. Ορισμένοι ασθενείς δεν είχαν εμφανείς παράγοντες κινδύνου για ηπατική νόσο. Ορισμένες από τις περιπτώσεις αυτές παρατηρήθηκαν εντός του πρώτου μήνα θεραπείας, συμπεριλαμβανομένων ορισμένων που εμφανίστηκαν εντός της πρώτης εβδομάδας. Σε ασθενείς που λαμβάνουν θεραπεία με SPORANOX θα πρέπει να λαμβάνεται υπόψη η παρακολούθηση της ηπατικής λειτουργίας. Θα πρέπει να δίδεται οδηγία στους ασθενείς να αναφέρουν έγκαιρα στους ιατρούς τους σημεία και συμπτώματα που υποδηλώνουν ηπατίτιδα όπως ανορεξία, ναυτία, έμετο, κόπωση, κοιλιακό άλγος ή σκουρόχρωμα ούρα. Σε αυτούς τους ασθενείς η θεραπεία θα πρέπει να διακόπτεται αμέσως και θα πρέπει να διενεργείται έλεγχος της ηπατικής λειτουργίας.
Διατίθενται περιορισμένα δεδομένα σχετικά με την από στόματος χρήση της ιτρακοναζόλης σε ασθενείς με ηπατική δυσλειτουργία. Συνιστάται προσοχή κατά τη χορήγηση του φαρμάκου στο συγκεκριμένο πληθυσμό ασθενών. Συνιστάται προσεκτική παρακολούθηση των ασθενών με διαταραχή της ηπατικής λειτουργίας κατά τη λήψη ιτρακοναζόλης. Κατά την απόφαση έναρξης θεραπείας με άλλα φάρμακα που μεταβολίζονται από το CYP3A4, συνιστάται να λαμβάνεται υπόψη ο παρατεταμένος χρόνος ημίσειας ζωής αποβολής της ιτρακοναζόλης που παρατηρήθηκε σε κλινική δοκιμή από στόματος χορηγούμενης εφάπαξ δόσης με καψάκια ιτρακοναζόλης σε κιρρωτικούς ασθενείς.
Αποθαρρύνεται έντονα η θεραπεία με SPORANOX σε ασθενείς με αυξημένα ή μη φυσιολογικά επίπεδα ηπατικών ενζύμων ή με ενεργό ηπατοπάθεια ή οι οποίοι έχουν εμφανίσει ηπατική τοξικότητα με άλλα φάρμακα, εκτός εάν υπάρχει σοβαρή ή απειλητική για τη ζωή κατάσταση για την οποία το αναμενόμενο όφελος υπερτερεί του κινδύνου. Συνιστάται παρακολούθηση της ηπατικής λειτουργίας σε ασθενείς με προϋπάρχουσες διαταραχές της ηπατικής λειτουργίας ή σε εκείνους που έχουν εμφανίσει ηπατική τοξικότητα με άλλα φάρμακα (βλέπε παράγραφο 5.2).
Κυστική ίνωση
Σε ασθενείς με κυστική ίνωση, παρατηρήθηκε μεταβλητότητα στα θεραπευτικά επίπεδα της ιτρακοναζόλης, με χορήγηση της δόσης του πόσιμου διαλύματος σε σταθερή κατάσταση χρησιμοποιώντας 2,5 mg/kg δις ημερησίως. Οι συγκεντρώσεις σταθερής κατάστασης άνω των 250 ng/ml, επετεύχθησαν σε περίπου 50% των ατόμων ηλικίας άνω των 16 ετών, αλλά σε κανέναν από τους ασθενείς ηλικίας μικρότερης των 16 ετών. Αν κάποιος ασθενής δεν ανταποκρίνεται στη θεραπεία με πόσιμο διάλυμα SPORANOX, πρέπει να ληφθεί υπόψη η μετάβαση σε SPORANOX I.V. ή σε εναλλακτική θεραπεία.
Παιδιατρικός πληθυσμός
Τα κλινικά δεδομένα για τη χρήση του πόσιμου διαλύματος SPORANOX σε παιδιατρικούς ασθενείς είναι περιορισμένα. Δεν συνιστάται η χρήση του πόσιμου διαλύματος SPORANOX σε παιδιατρικούς ασθενείς εκτός αν το αναμενόμενο όφελος υπερτερεί των δυνητικών κινδύνων.
Ηλικιωμένοι
Διατίθενται περιορισμένα κλινικά δεδομένα σχετικά με τη χρήση του πόσιμου διαλύματος SPORANOX σε ηλικιωμένους ασθενείς. Η χρήση του πόσιμου διαλύματος SPORANOX στους συγκεκριμένους ασθενείς συνιστάται μόνο αν προσδιοριστεί ότι το δυνητικό όφελος υπερτερεί των δυνητικών κινδύνων. Σε γενικές γραμμές, συνιστάται να λαμβάνεται υπόψη η επιλογή της δόσης για ηλικιωμένους ασθενείς, αποτυπώνοντας τη μεγαλύτερη συχνότητα εμφάνισης μειωμένης ηπατικής, νεφρικής ή καρδιακής λειτουργίας και συνυπάρχουσας νόσου ή άλλης φαρμακευτικής θεραπείας.
Νεφρική δυσλειτουργία
Διατίθενται περιορισμένα δεδομένα αναφορικά με τη χρήση της από στόματος χορηγούμενης ιτρακοναζόλης σε ασθενείς με νεφρική δυσλειτουργία. Η έκθεση στην ιτρακοναζόλη μπορεί να είναι χαμηλότερη σε ορισμένους ασθενείς με νεφρική ανεπάρκεια. Συνιστάται προσοχή όταν αυτό το φάρμακο χορηγείται σε αυτό τον πληθυσμό ασθενών και μπορεί να εξεταστεί το ενδεχόμενο προσαρμογής της δόσης.
Θεραπεία ασθενών με σοβαρή ουδετεροπενία
Το πόσιμο διάλυμα SPORANOX ως θεραπεία για τη στοματική και/ή οισοφαγική καντιντίαση δεν έχει διερευνηθεί σε ασθενείς με σοβαρή ουδετεροπενία. Εξαιτίας των ιδιοτήτων φαρμακοκινητικής (βλέπε παράγραφο 5.2), το πόσιμο διάλυμα SPORANOX δεν συνιστάται για την έναρξη της θεραπείας σε ασθενείς που διατρέχουν άμεσο κίνδυνο εμφάνισης συστηματικής καντιντίασης.
Προειδοποιήσεις σχετικά με τα περιεχόμενα έκδοχα
Το πόσιμο διάλυμα SPORANOX περιέχει σορβιτόλη και δεν πρέπει να χορηγείται σε ασθενείς με σπάνια κληρονομικά προβλήματα δυσανεξίας στη φρουκτόζη.
Ασυμβατότητες
Καμία γνωστή.
Ανεπιθύμητες ενέργειες
Περίληψη του προφίλ ασφάλειας
Οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες κατά τη θεραπεία με πόσιμο διάλυμα SPORANOX που εντοπίστηκαν σε κλινικές δοκιμές και/ή από αυθόρμητες αναφορές ήταν ζάλη, κεφαλαλγία, δυσγευσία, δύσπνοια, βήχας, κοιλιακό άλγος, διάρροια, έμετος, ναυτία, δυσπεψία, εξάνθημα και πυρεξία. Οι πιο σοβαρές ανεπιθύμητες ενέργειες ήταν σοβαρές αλλεργικές αντιδράσεις, καρδιακή ανεπάρκεια/συμφορητική καρδιακή ανεπάρκεια/πνευμονικό οίδημα, παγκρεατίτιδα, σοβαρή ηπατοτοξικότητα (συμπεριλαμβανομένων ορισμένων περιπτώσεων οξείας ηπατικής ανεπάρκειας) και σοβαρές δερματικές αντιδράσεις. Ανατρέξτε στην υποενότητα Πίνακας ανεπιθύμητων ενεργειών για τις συχνότητες και άλλες ανεπιθύμητες ενέργειες που παρατηρήθηκαν. Ανατρέξτε στην παράγραφο 4.4 για περισσότερες πληροφορίες σχετικά με άλλες σοβαρές ανεπιθύμητες ενέργειες.
Πίνακας ανεπιθύμητων ενεργειών
Οι ανεπιθύμητες ενέργειες στον πίνακα που ακολουθεί προέρχονται από αυθόρμητες αναφορές και από ανοικτού σχεδιασμού και διπλά τυφλές, κλινικές δοκιμές για τη θεραπεία στοματοφαρυγγικής και οισοφαγικής καντιντίασης με πόσιμο διάλυμα SPORANOX στις οποίες συμμετείχαν 889 ασθενείς.
Ο παρακάτω πίνακας παρουσιάζει τις ανεπιθύμητες ενέργειες κατά Κατηγορία/Οργανικό Σύστημα. Εντός κάθε Κατηγορίας/Οργανικού Συστήματος, η συχνότητα εμφάνισης των ανεπιθύμητων ενεργειών παρουσιάζεται με βάση την ακόλουθη συνθήκη: Πολύ συχνές (≥1/10), Συχνές (≥ 1/100 έως <1/10), Όχι συχνές (≥ 1/1000 έως <1/100), Σπάνιες (≥ 1/10.000 έως <1/1.000), Πολύ σπάνιες (<1/10.000), Μη γνωστές (δεν μπορούν να εκτιμηθούν με βάση τα διαθέσιμα δεδομένα).
Διαταραχές του αιμοποιητικού και του λεμφικού συστήματος
Όχι συχνές: Λευκοπενία, θρομβοπενία
Διαταραχές του ανοσοποιητικού συστήματος
Όχι συχνές: Υπερευαισθησία*
Μη γνωστές: Ορονοσία, αγγειονευρωτικό οίδημα, αναφυλακτική αντίδραση
Διαταραχές του μεταβολισμού και της θρέψης
Όχι συχνές: Υποκαλιαιμία
Μη γνωστές: Υπερτριγλυκεριδαιμία
Διαταραχές του νευρικού συστήματος
Συχνές: Ζάλη, κεφαλαλγία, δυσγευσία
Όχι συχνές: Περιφερική νευροπάθεια*, παραισθησία, υπαισθησία
Μη γνωστές: Τρόμος
Οφθαλμικές διαταραχές
Όχι συχνές: Οπτικές διαταραχές (συμπεριλαμβανομένων διπλωπίας και θαμπής όρασης)
Διαταραχές του ωτός και του λαβυρίνθου
Όχι συχνές: Εμβοές
Μη γνωστές: Παροδική ή μόνιμη απώλεια ακοής*
Καρδιακές διαταραχές
Όχι συχνές: Καρδιακή ανεπάρκεια
Μη γνωστές: Συμφορητική καρδιακή ανεπάρκεια*
Διαταραχές του αναπνευστικού συστήματος, του θώρακα και του μεσοθωράκιου
Συχνές: Δύσπνοια, βήχας
Διαταραχές του γαστρεντερικού
Συχνές: Κοιλιακό άλγος, διάρροια, έμετος, ναυτία, δυσπεψία
Όχι συχνές: Δυσκοιλιότητα
Μη γνωστές: Παγκρεατίτιδα
Διαταραχές του ήπατος και των χοληφόρων
Όχι συχνές: Ηπατική ανεπάρκεια*, υπερχολερυθριναιμία
Μη γνωστές: Σοβαρή ηπατοτοξικότητα (συμπεριλαμβανομένων ορισμένων περιπτώσεων θανατηφόρου οξείας ηπατικής ανεπάρκειας)*
Διαταραχές του δέρματος και του υποδόριου ιστού
Συχνές: Εξάνθημα
Όχι συχνές: Κνίδωση, κνησμός
Μη γνωστές: Τοξική επιδερμική νεκρόλυση, σύνδρομο Stevens-Johnson, οξεία γενικευμένη εξανθηματική φλυκταίνωση, πολύμορφο ερύθημα, αποφολιδωτική δερματίτιδα, λευκοκυτταροκλαστική αγγειίτιδα, αλωπεκία, φωτοευαισθησία
Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού
Όχι συχνές: Μυαλγία, αρθραλγία
Διαταραχές του αναπαραγωγικού συστήματος και του μαστού
Όχι συχνές: Διαταραχές εμμήνου ρύσης
Γενικές διαταραχές και καταστάσεις της οδού χορήγησης
Συχνές: Πυρεξία
Όχι συχνές: Οίδημα
Παρακλινικές εξετάσεις
Όχι γνωστές: Αυξημένη κρεατινοφωσφοκινάση αίματος
* Βλέπε παράγραφο 4.4
Περιγραφή επιλεγμένων ανεπιθύμητων ενεργειών
Στον κατάλογο που ακολουθεί παρουσιάζονται οι επιπρόσθετες ανεπιθύμητες ενέργειες που σχετίστηκαν με την ιτρακοναζόλη και αναφέρθηκαν σε κλινικές δοκιμές με τα καψάκια SPORANOX και/ή το SPORANOX I.V., εκτός από την ανεπιθύμητη ενέργεια με τον όρο “Φλεγμονή της θέσης ένεσης”, που είναι ειδικός για την ενέσιμη οδό χορήγησης.
Λοιμώξεις και παρασιτώσεις: Κολπίτιδα, λοίμωξη του ανώτερου αναπνευστικού συστήματος, ρινίτιδα
Διαταραχές του αιμοποιητικού και του λεμφικού συστήματος: Κοκκιοκυτταροπενία
Διαταραχές του ανοσοποιητικού συστήματος: Αναφυλακτοειδής αντίδραση
Διαταραχές του μεταβολισμού και της θρέψης: Υπεργλυκαιμία, υπερκαλιαιμία, υπομαγνησιαιμία
Ψυχιατρικές διαταραχές: Συγχυτική κατάσταση
Διαταραχές του νευρικού συστήματος: Υπνηλία
Καρδιακές διαταραχές: Ανεπάρκεια της αριστερής κοιλίας, ταχυκαρδία
Αγγειακές διαταραχές: Υπέρταση, υπόταση
Διαταραχές του αναπνευστικού συστήματος, του θώρακα και του μεσοθωράκιου: Πνευμονικό οίδημα, δυσφωνία
Διαταραχές του γαστρεντερικού: Γαστρεντερική διαταραχή, μετεωρισμός
Διαταραχές του ήπατος και των χοληφόρων: Ηπατίτιδα, ίκτερος, μη φυσιολογική ηπατική λειτουργία
Διαταραχές του δέρματος και του υποδόριου ιστού: Ερυθηματώδες εξάνθημα, υπεριδρωσία
Διαταραχές των νεφρών και των ουροφόρων οδών: Νεφρική δυσλειτουργία, πολυουρία, ακράτεια ούρων
Διαταραχές του αναπαραγωγικού συστήματος και του μαστού: Στυτική δυσλειτουργία
Γενικές διαταραχές και καταστάσεις της οδού χορήγησης: Γενικευμένο οίδημα, οίδημα προσώπου, θωρακικό άλγος, άλγος, κόπωση, ρίγη
Παρακλινικές εξετάσεις: Αυξημένη αμινοτρανσφεράση της αλανίνης, αυξημένη ασπαρτική αμινοτρανσφεράση, αυξημένη αλκαλική φωσφατάση αίματος, αυξημένη γαλακτική αφυδρογονάση αίματος, αυξημένη ουρία αίματος, αυξημένη γ-γλουταμυλτρανσφεράση, αυξημένα ηπατικά ένζυμα, μη φυσιολογική ανάλυση ούρων.
Παιδιατρικός πληθυσμός
Η ασφάλεια του πόσιμου διαλύματος SPORANOX αξιολογήθηκε σε 250 παιδιατρικούς ασθενείς ηλικίας 6 μηνών έως 14 ετών οι οποίοι συμμετείχαν σε πέντε ανοικτού σχεδιασμού κλινικές δοκιμές. Αυτοί οι ασθενείς έλαβαν τουλάχιστον μία δόση πόσιμου διαλύματος SPORANOX για προφύλαξη από μυκητιασικές λοιμώξεις ή για τη θεραπεία μυκητιασικής στοματίτιδας ή συστηματικών μυκητιασικών λοιμώξεων και προέκυψαν δεδομένα ασφάλειας. Με βάση τα συγκεντρωτικά δεδομένα ασφάλειας αυτών των κλινικών δοκιμών, οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες σε παιδιατρικούς ασθενείς ήταν Έμετος (36,0%), Πυρεξία (30,8%), Διάρροια (28,4%), Φλεγμονή βλεννογόνου (23,2%), Εξάνθημα (22,8%), Κοιλιακό άλγος (17,2%), Ναυτία (15,6%), Υπέρταση (14,0%) και Βήχας (11,2%). Η φύση των ανεπιθύμητων ενεργειών σε παιδιατρικούς ασθενείς είναι παρόμοια με αυτή που παρατηρήθηκε σε ενήλικες ασθενείς αλλά η συχνότητα εμφάνισης είναι υψηλότερη στους παιδιατρικούς ασθενείς.
Αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών
Η αναφορά πιθανολογούμενων ανεπιθύμητων ενεργειών μετά από τη χορήγηση άδειας κυκλοφορίας του φαρμακευτικού προϊόντος είναι σημαντική. Επιτρέπει τη συνεχή παρακολούθηση της σχέσης οφέλους-κινδύνου του φαρμακευτικού προϊόντος. Ζητείται από τους επαγγελματίες του τομέα της υγειονομικής περίθαλψης να αναφέρουν οποιεσδήποτε πιθανολογούμενες ανεπιθύμητες ενέργειες απευθείας στον Εθνικό Οργανισμό Φαρμάκων (Μεσογείων 284, 15562, Χολαργός, www.eof.gr).
Αλληλεπιδράσεις με άλλα φάρμακα ή ουσίες
Η ιτρακοναζόλη μεταβολίζεται κυρίως μέσω του CYP3A4. Άλλες ουσίες που είτε έχουν κοινή μεταβολική οδό είτε τροποποιούν τη δράση του CYP3A4 μπορεί να επηρεάσουν τη φαρμακοκινητική της ιτρακοναζόλης. Παρομοίως, η ιτρακοναζόλη μπορεί να επηρεάσει τη φαρμακοκινητική άλλων ουσιών που έχουν κοινή μεταβολική οδό. Η ιτρακοναζόλη είναι ισχυρός αναστολέας του CYP3A4 και αναστολέας της P-γλυκοπρωτεΐνης. Κατά τη χρήση συγχορηγούμενων φαρμακευτικών αγωγών, συνιστάται να λαμβάνονται υπόψη τα συνταγογραφικά τους στοιχεία για πληροφορίες σχετικά με τη μεταβολική οδό και την πιθανή ανάγκη για προσαρμογή των δόσεων.
Φάρμακα που μπορεί να μειώσουν τις συγκεντρώσεις της ιτρακοναζόλης στο πλάσμα
Η συγχορήγηση της ιτρακοναζόλης με ισχυρούς επαγωγείς του ενζύμου CYP3A4 μπορεί να μειώσει τη βιοδιαθεσιμότητα της ιτρακοναζόλης και της υδροξυ-ιτρακοναζόλης σε τέτοιο βαθμό ώστε να μειωθεί η αποτελεσματικότητα. Τα παραδείγματα περιλαμβάνουν:
- Αντιβακτηριακά: ισονιαζίδη, ριφαμπουτίνη (βλέπε επίσης Φάρμακα των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να αυξηθούν από την ιτρακοναζόλη), ριφαμπικίνη,
- Αντιεπιληπτικά: καρβαμαζεπίνη (βλέπε επίσης Φάρμακα των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να αυξηθούν από την ιτρακοναζόλη), φαινοβαρβιτάλη, φαινυτοΐνη,
- Αντι-ιικά: εφαβιρένζη, νεβιραπίνη.
Ως εκ τούτου, δεν συνιστάται η χορήγηση ισχυρών επαγωγέων του ενζύμου CYP3A4 με την ιτρακοναζόλη. Συνιστάται να αποφεύγεται η χρήση αυτών των φαρμάκων 2 εβδομάδες πριν τη θεραπεία με ιτρακοναζόλη και κατά τη διάρκεια αυτής, εκτός εάν τα οφέλη υπερτερούν του δυνητικού κινδύνου εμφάνισης μειωμένης αποτελεσματικότητας της ιτρακοναζόλης. Κατά τη συγχορήγηση συνιστάται η παρακολούθηση της αντιμυκητιασικής δράσης και η αύξηση της δόσης της ιτρακοναζόλης όπως κρίνεται απαραίτητο.
Φάρμακα που μπορεί να αυξήσουν τις συγκεντρώσεις της ιτρακοναζόλης στο πλάσμα
Οι ισχυροί αναστολείς του CYP3A4 μπορεί να αυξήσουν τη βιοδιαθεσιμότητα της ιτρακοναζόλης.
Τα παραδείγματα περιλαμβάνουν:
- Αντιβακτηριακά: σιπροφλοξασίνη, κλαριθρομυκίνη, ερυθρομυκίνη,
- Αντι-ιικά: δαρουναβίρη ενισχυμένη με ριτοναβίρη, φοσαμπρεναβίρη ενισχυμένη με ριτοναβίρη, ινδιναβίρη (βλέπε επίσης Φάρμακα των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να αυξηθούν από την ιτρακοναζόλη), ριτοναβίρη (βλέπε επίσης Φάρμακα των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να αυξηθούν από την ιτρακοναζόλη) και τελαπρεβίρη.
Συνιστάται να χρησιμοποιούνται με προσοχή αυτά τα φάρμακα όταν συγχορηγούνται με το πόσιμο διάλυμα ιτρακοναζόλης. Συνιστάται να παρακολουθούνται στενά οι ασθενείς που πρέπει να πάρουν ιτρακοναζόλη μαζί με ισχυρούς αναστολείς του CYP3A4 για σημεία ή συμπτώματα αυξημένων ή παρατεταμένων φαρμακολογικών επιδράσεων της ιτρακοναζόλης και να μειώνεται η δόση της ιτρακοναζόλης όπως κρίνεται απαραίτητο. Όταν χρειάζεται, συνιστάται να μετρώνται οι συγκεντρώσεις της ιτρακοναζόλης στο πλάσμα.
Φάρμακα των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να αυξηθούν από την ιτρακοναζόλη
Η ιτρακοναζόλη και ο κύριος μεταβολίτης της, η υδροξυ-ιτρακοναζόλη μπορούν να αναστείλουν το μεταβολισμό φαρμάκων που μεταβολίζονται από το CYP3A4 και μπορούν να αναστείλουν τη μεταφορά φαρμάκων από την P-γλυκοπρωτεΐνη,. Το γεγονός αυτό μπορεί να οδηγήσει σε αυξημένες συγκεντρώσεις αυτών των φαρμάκων και/ή των ενεργών μεταβολιτών τους στο πλάσμα όταν συγχορηγούνται μαζί με ιτρακοναζόλη. Αυτές οι αυξημένες συγκεντρώσεις στο πλάσμα μπορεί να αυξήσουν ή να παρατείνουν τόσο τις θεραπευτικές όσο και τις ανεπιθύμητες ενέργειες αυτών των φαρμάκων. Τα φάρμακα που μεταβολίζονται από το CYP3A4 και είναι γνωστό ότι παρατείνουν το διάστημα QT μπορεί να αντενδείκνυνται με την ιτρακοναζόλη, καθώς ο συνδυασμός μπορεί να οδηγήσει σε κοιλιακές ταχυαρρυθμίες συμπεριλαμβανομένων επεισοδίων κοιλιακής αρρυθμίας δίκην ριπιδίου (torsade de pointes), μίας δυνητικά θανατηφόρου αρρυθμίας. Μόλις διακοπεί η θεραπεία, οι συγκεντρώσεις της ιτρακοναζόλης στο πλάσμα μειώνονται σε σχεδόν μη ανιχνεύσιμα επίπεδα εντός 7 έως 14 ημερών, ανάλογα με τη δόση και τη διάρκεια της θεραπείας. Σε ασθενείς με ηπατική κίρρωση ή σε άτομα που λαμβάνουν αναστολείς του CYP3A4, η μείωση των συγκεντρώσεων στο πλάσμα μπορεί να είναι ακόμα πιο σταδιακή. Αυτό είναι ιδιαίτερα σημαντικό όταν γίνεται έναρξη θεραπείας με φάρμακα των οποίων ο μεταβολισμός επηρεάζεται από την ιτρακοναζόλη.
Τα αλληλεπιδρώντα φάρμακα χωρίζονται στις εξής κατηγορίες:
- Μη ενδεικνυόμενο: Σε καμία περίπτωση το φάρμακο δεν πρέπει να συγχορηγηθεί με ιτρακοναζόλη, έως και δύο εβδομάδες μετά τη διακοπή της θεραπείας με ιτρακοναζόλη.
- Μη συνιστώμενο: Συνιστάται η αποφυγή της χρήσης του φαρμάκου κατά τη διάρκεια της θεραπείας με ιτρακοναζόλη έως και δύο εβδομάδες μετά τη διακοπή της, εκτός εάν τα οφέλη υπερτερούν των δυνητικών αυξημένων κινδύνων για εμφάνιση ανεπιθύμητων ενεργειών. Εάν η συγχορήγηση δεν μπορεί να αποφευχθεί, συνιστάται κλινική παρακολούθηση για σημεία ή συμπτώματα αυξημένων ή παρατεταμένων επιδράσεων ή ανεπιθύμητων ενεργειών του αλληλεπιδρώντος φαρμάκου και μείωση ή διακοπή της δοσολογίας όπως κρίνεται απαραίτητο. Όταν χρειάζεται, συνιστάται η μέτρηση των συγκεντρώσεων στο πλάσμα.
- Χρήση με προσοχή: Συνιστάται προσεκτική παρακολούθηση κατά τη συγχορήγηση του φαρμάκου με ιτρακοναζόλη. Κατά τη συγχορήγηση, συνιστάται στενή παρακολούθηση των ασθενών για σημεία ή συμπτώματα αυξημένων ή παρατεταμένων επιδράσεων ή ανεπιθύμητων ενεργειών του αλληλεπιδρώντος φαρμάκου, καθώς και μείωση της δοσολογίας του όπως κρίνεται απαραίτητο. Όταν χρειάζεται, συνιστάται η μέτρηση των συγκεντρώσεων στο πλάσμα.
Παραδείγματα φαρμάκων των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να αυξηθούν από την ιτρακοναζόλη παρουσιάζονται ανά φαρμακευτική κατηγορία με συμβουλές που αφορούν στη συγχορήγηση με ιτρακοναζόλη:
Φάρμακα των οποίων οι συγκεντρώσεις στο πλάσμα μπορεί να μειωθούν από την ιτρακοναζόλη
Η συγχορήγηση της ιτρακοναζόλης με το ΜΣΑΦ, μελοξικάμη, μπορεί να μειώσει τις συγκεντρώσεις της μελοξικάμης στο πλάσμα. Κατά τη συγχορήγηση με ιτρακοναζόλη συνιστάται προσεκτική χρήση της μελοξικάμης, καθώς και η παρακολούθηση των επιδράσεων ή των ανεπιθύμητων ενεργειών της. Συνιστάται η προσαρμογή της δοσολογίας της μελοξικάμης κατά τη συγχορήγηση με ιτρακοναζόλη, αν κρίνεται απαραίτητο.
Παιδιατρικός πληθυσμός
Μελέτες αλληλεπιδράσεων έχουν πραγματοποιηθεί μόνο σε ενήλικες.
Κύηση
Το SPORANOX δεν πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης, εκτός από περιπτώσεις που είναι απειλητικές για τη ζωή, εφόσον το δυνητικό όφελος στη μητέρα υπερτερεί της δυνητικής βλάβης στο έμβρυο (βλέπε παράγραφο 4.3).
Σε μελέτες σε ζώα η ιτρακοναζόλη κατέδειξε τοξικότητα κατά την αναπαραγωγή (Βλέπε παράγραφο 5.3).
Υπάρχουν περιορισμένα δεδομένα σχετικά με τη χρήση του SPORANOX κατά τη διάρκεια της εγκυμοσύνης. Κατά την εμπειρία μετά από την κυκλοφορία του φαρμάκου, έχουν αναφερθεί περιπτώσεις συγγενών ανωμαλιών. Στις περιπτώσεις αυτές περιλαμβάνονται σκελετικές δυσπλασίες, δυσπλασίες του ουροποιογεννητικού συστήματος, καρδιαγγειακές και οφθαλμικές δυσπλασίες, καθώς και χρωμοσωμικές και πολλαπλές δυσπλασίες. Δεν έχει τεκμηριωθεί αιτιολογική συσχέτιση με το SPORANOX.
Επιδημιολογικά δεδομένα σχετικά με την έκθεση σε SPORANOX κατά το πρώτο τρίμηνο της εγκυμοσύνης – κυρίως σε ασθενείς που λάμβαναν βραχύχρονη θεραπεία για αιδοιοκολπική καντιντίαση δεν έδειξαν αυξημένο κίνδυνο εμφάνισης δυσπλασιών σε σύγκριση με την ομάδα ελέγχου που δεν είχε εκτεθεί σε γνωστά τερατογόνα. Έχει αποδειχθεί ότι η ιτρακοναζόλη διαπερνά τον πλακούντα σε μοντέλο αρουραίων.
Γυναίκες σε αναπαραγωγική ηλικία
Γυναίκες που βρίσκονται σε αναπαραγωγική ηλικία και χρησιμοποιούν το πόσιμο διάλυμα SPORANOX πρέπει να λαμβάνουν αντισυλληπτικές προφυλάξεις. Η αποτελεσματική αντισύλληψη πρέπει να συνεχίζεται ως την έμμηνο ρύση που θα ακολουθήσει μετά το τέλος της θεραπείας με SPORANOX.
Γαλουχία
Ένα πολύ μικρό ποσοστό ιτρακοναζόλης απεκκρίνεται στο ανθρώπινο γάλα. Ως εκ τούτου, θα πρέπει να αντισταθμίζονται τα αναμενόμενα οφέλη της θεραπείας με πόσιμο διάλυμα SPORANOX έναντι του ενδεχόμενου κινδύνου από το θηλασμό. Σε περίπτωση που υπάρχει αμφιβολία, η ασθενής δεν πρέπει να θηλάζει.
Ικανότητα οδήγησης και χειρισμός μηχανημάτων
Δεν έχουν πραγματοποιηθεί μελέτες για την επίδραση στην ικανότητα οδήγησης και χειρισμού μηχανών. Κατά την οδήγηση οχημάτων και χειρισμό μηχανών, πρέπει να λαμβάνεται υπόψη η πιθανότητα εμφάνισης ανεπιθύμητων ενεργειών όπως ζάλη, οπτικές διαταραχές και απώλεια ακοής (βλέπε παράγραφο 4.8), οι οποίες μπορεί να εμφανιστούν σε ορισμένες περιπτώσεις.
Σχετικό SPC
SPORANOX 10 mg/ml πόσιμο διάλυμα.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.