Φαρμακοδυναμική
Φαρμακοθεραπευτική κατηγορία: Αδρενεργικά σε συνδυασμό με κορτικοστεροειδή ή άλλα φάρμακα, εξαιρουμένων των αντιχολινεργικών.
Κωδικός ATC: R03AK06
Μηχανισμός δράσης και φαρμακοδυναμικές επιδράσεις
Το Seretide περιέχει σαλμετερόλη και προπιονική φλουτικαζόνη, οι οποίες έχουν διαφορετικούς μηχανισμούς δράσης.
Οι αντίστοιχοι μηχανισμοί δράσης και των δύο φαρμάκων παρατίθενται παρακάτω:
Σαλμετερόλη
Η σαλμετερόλη είναι ένας εκλεκτικός, παρατεταμένης δράσης (12 ώρες) β2 αδρενεργικός διεγέρτης, που διαθέτει μία μακριά πλευρική άλυσο, η οποία συνδέεται με το ειδικό τμήμα του υποδοχέα.
Η σαλμετερόλη προκαλεί μία μεγαλύτερης διάρκειας βρογχοδιαστολή η οποία διαρκεί τουλάχιστον 12 ώρες, συγκρινόμενη με τις συνιστώμενες δόσεις των συμβατικών β2 διεγερτών βραχείας διάρκειας δράσης.
Προπιονική φλουτικαζόνη
Η προπιονική φλουτικαζόνη χορηγούμενη σε εισπνοές στις συνιστώμενες δόσεις, έχει γλυκοκορτικοειδική αντιφλεγμονώδη δράση στους πνεύμονες, με αποτέλεσμα την μείωση των συμπτωμάτων και των εξάρσεων του άσθματος, με λιγότερες ανεπιθύμητες ενέργειες συγκριτικά με τη συστηματική χορήγηση κορτικοστεροειδών.
Κλινική αποτελεσματικότητα και ασφάλεια
Kλινικές μελέτες του Seretide σε άσθμα
Μία μελέτη διάρκειας 12 μηνών (Επιτυγχάνοντας τον βέλτιστο έλεγχο του άσθματος - Gaining Optimal Asthma ControL, GOAL), σε 3416 ενήλικες και εφήβους ασθενείς με επίμονο άσθμα, σύγκρινε την ασφάλεια και την αποτελεσματικότητα του Seretide έναντι της μονοθεραπείας με εισπνεόμενο κορτικοστεροειδές (Προπιονική Φλουτικαζόνη) με σκοπό να διερευνήσει εάν οι στόχοι της αντιμετώπισης του άσθματος είναι εφικτοί. Η θεραπεία αυξανόταν σταδιακά κάθε 12 εβδομάδες μέχρι να επιτευχθεί ο πλήρης έλεγχος** ή μέχρι να χορηγηθεί η μεγαλύτερη δόση του υπό μελέτη φαρμάκου. Η μελέτη GOAL έδειξε ότι περισσότεροι ασθενείς που έλαβαν Seretide πέτυχαν έλεγχο του άσθματος συγκριτικά με τους ασθενείς που έλαβαν μονοθεραπεία με εισπνεόμενο κορτικοστεροειδές και αυτός ο έλεγχος επιτεύχθηκε με χαμηλότερη δόση κορτικοστεροειδούς.
* Καλά ελεγχόμενο άσθμα επιτεύχθηκε γρηγορότερα με το Seretide από ότι μόνο με εισπνεόμενο κορτικοστεροειδές. Ο χρόνος θεραπείας για την επίτευξη της πρώτης ατομικής καλά ελεγχόμενης εβδομάδας για το 50% των ασθενών ήταν 16 ημέρες για το Seretide συγκριτικά με 37 ημέρες για την ομάδα του εισπνεόμενου κορτικοστεροειδούς. Στην υποομάδα των ασθματικών που δεν είχαν ξαναπάρει στεροειδή ο χρόνος για μία ατομική καλά ελεγχόμενη εβδομάδα ήταν 16 ημέρες με θεραπεία Seretide συγκριτικά με 23 ημέρες μετά από θεραπεία με εισπνεόμενο κορτικοστεροειδές.
Τα συνολικά αποτελέσματα της μελέτης έδειξαν:
Τα αποτελέσματα της μελέτης αυτής δείχνουν ότι σε ασθενείς με μέτριο επίμονο άσθμα για τους οποίους ο γρήγορος έλεγχος του άσθματος θεωρείται ουσιώδης, μπορεί να εξετασθεί το ενδεχόμενο χορήγησης Seretide 50/100 μικρογραμμαρίων δύο φορές την ημέρα, ως αρχική θεραπεία συντήρησης (βλέπε παράγραφο 4.2).
Μία διπλή-τυφλή, τυχαιοποιημένη, παραλλήλων ομάδων μελέτη σε 318 ασθενείς με επιμένον άσθμα, ηλικίας ≥18 ετών, αξιολόγησε την ασφάλεια και την ανεκτικότητα της χορήγησης δύο εισπνοών δύο φορές την ημέρα (διπλάσια δόση) Seretide για δύο εβδομάδες. Η μελέτη έδειξε ότι ο διπλασιασμός των εισπνοών κάθε περιεκτικότητας του Seretide μέχρι και 14 ημέρες είχε ως αποτέλεσμα μία μικρή αύξηση των ανεπιθύμητων ενεργειών που σχετίζονται με τους β αγωνιστές (τρόμος: 1 ασθενής [1%] έναντι 0, αίσθημα παλμών: 6 [3%] έναντι 1 [<1%], μυϊκές κράμπες: 6 [3%] έναντι 1 [<1%]), καθώς και μία παρόμοια αύξηση των ανεπιθύμητων ενεργειών που σχετίζονται με τα εισπνεόμενα κορτικοστεροειδή (π.χ. στοματική καντιντίαση, 6 [6%] έναντι 16 [8%], βράγχος φωνής, 2 [2%] έναντι 4 [2%]), συγκριτικά με τη χορήγηση μίας εισπνοής δύο φορές την ημέρα. Η μικρή αύξηση των ανεπιθύμητων ενεργειών σχετιζόμενων με τους β αγωνιστές θα πρέπει να λαμβάνεται υπόψη εάν ο γιατρός εξετάζει το ενδεχόμενο διπλασιασμού της δόσης του Seretide σε ενήλικες ασθενείς που χρειάζονται επιπρόσθετη βραχυχρόνια (μέχρι 14 ημέρες) θεραπεία με εισπνεόμενα κορτικοστεροειδή.
Κλινικές μελέτες του Seretide σε ΧΑΠ
Η TORCH ήταν μία 3ετής μελέτη που αξιολόγησε την επίδραση της θεραπείας με Seretide Diskus 50/500 μικρογραμμάρια δύο φορές την ημέρα, σαλμετερόλη Diskus 50 μικρογραμμάρια δύο φορές την ημέρα, προπιονική φλουτικαζόνη (FP) Diskus 500 μικρογραμμάρια δύο φορές την ημέρα ή εικονικό φάρμακο στην ολική θνησιμότητα (θνησιμότητα από κάθε αιτία) σε ασθενείς με ΧΑΠ. Οι ασθενείς με ΧΑΠ με FEV1 <60% (προ βρογχοδιαστολής) της αναμενόμενης φυσιολογικής κατά την έναρξη της θεραπείας, τυχαιοποιήθηκαν σε διπλά- τυφλή φαρμακευτική αγωγή. Κατά τη διάρκεια της μελέτης επιτράπηκε στους ασθενείς η συνήθης θεραπεία για ΧΑΠ με την εξαίρεση άλλων εισπνεόμενων κορτικοστεροειδών, βρογχοδιασταλτικών μακράς δράσης και τη μακροχρόνια χορήγηση συστηματικών κορτικοστεροειδών. Η κατάσταση επιβίωσης στα 3 χρόνια υπολογίστηκε για όλους τους ασθενείς ανεξάρτητα από το αν αποσύρθηκαν από την φαρμακευτική αγωγή της μελέτης. Το πρωτεύον τελικό σημείο ήταν η μείωση της ολικής θνησιμότητας στα 3 χρόνια για το Seretide έναντι του εικονικού φαρμάκου.
Υπήρξε μία τάση για μεγαλύτερη επιβίωση των ατόμων που έλαβαν Seretide συγκριτικά με το εικονικό φάρμακο σε μία περίοδο 3 ετών, ωστόσο αυτό δεν πέτυχε το στατιστικά σημαντικό επίπεδο p≤0,05.
Το ποσοστό ασθενών που πέθανε εντός 3 ετών λόγω σχετιζόμενων με τη ΧΑΠ αιτίων ήταν 6,0% για το εικονικό φάρμακο, 6,1% για τη σαλμετερόλη, 6,9% για την προπιονική φλουτικαζόνη και 4,7% για το Seretide.
Ο μέσος αριθμός των μέτριων έως σοβαρών παροξυσμών ανά έτος μειώθηκε σημαντικά με το Seretide συγκριτικά με τη θεραπεία σαλμετερόλης, προπιονικής φλουτικαζόνης και εικονικού φαρμάκου (μέσος ποσοστό στην ομάδα του Seretide 0,85 συγκριτικά με 0,97 στην ομάδα της σαλμετερόλης, 0,93 στην ομάδα της προπιονικής φλουτικαζόνης και 1,13 στην ομάδα του εικονικού φαρμάκου). Αυτό μεταφράζεται σε μείωση του ποσοστού μέτριων έως σοβαρών παροξυσμών κατά 25% (95% CI: 19% έως 31%, p<0,001) συγκριτικά με εικονικό φάρμακο, 12% συγκριτικά με τη σαλμετερόλη (95% CI: 5% έως 19%, p=0,002) και κατά 9% συγκριτικά με την προπιονική φλουτικαζόνη (95% CI: 1% έως 16%, p=0,024). Η σαλμετερόλη και η προπιονική φλουτικαζόνη μείωσαν σημαντικά τα ποσοστά παροξυσμών συγκριτικά με το εικονικό φάρμακο κατά 15% (95% CI: 7% έως 22%; p<0,001) και 18% (95% CI: 11% έως 24%; p<0,001) αντίστοιχα.
Η ποιότητα ζωής ως προς την υγεία, όπως μετρήθηκε με το αναπνευστικό ερωτηματολόγιο St George (SGRQ) βελτιώθηκε από όλα τα φαρμακευτικά σχήματα συγκριτικά με το εικονικό φάρμακο. Η μέση βελτίωση στα τρία χρόνια για το Seretide συγκριτικά με το εικονικό φάρμακο ήταν -3,1 μονάδες (95% CI: -4,1 έως -2,1; p<0,001), συγκριτικά με τη σαλμετερόλη ήταν -2,2 μονάδες (p<0,001) και συγκριτικά με την προπιονική φλουτικαζόνη ήταν ‑1,2 μονάδες (p=0,017). Μία μείωση 4 μονάδων θεωρήθηκε κλινικά σημαντική.
Η προβλεπόμενη πιθανότητα εμφάνισης πνευμονίας στα 3 έτη που αναφέρθηκε ως ανεπιθύμητη ενέργεια ήταν 12,3% για το εικονικό φάρμακο, 13,3% για τη σαλμετερόλη, 18,3% για την προπιονική φλουτικαζόνη και 19,6% για το Seretide (Αναλογία κινδύνου για το Seretide vs εικονικού φαρμάκου: 1,64, 95% CI: 1,33 έως 2,01, p<0.001). Δεν υπήρξε αύξηση των σχετιζόμενων με την πνευμονία θανάτων: οι θάνατοι κατά τη διάρκεια της θεραπείας που θεωρήθηκαν ως κυρίως οφειλόμενοι σε πνευμονία ήταν 7 για το εικονικό φάρμακο, 9 για τη σαλμετερόλη, 13 για την προπιονική φλουτικαζόνη και 8 για το Seretide. Δεν υπήρξε σημαντική διαφορά στην πιθανότητα καταγμάτων (5,1% εικονικό φάρμακο, 5,1% σαλμετερόλη, 5,4% προπιονική φλουτικαζόνη και 6,3% Seretide; Αναλογία κινδύνου για το Seretide vs εικονικού φαρμάκου: 1,22, 95% CI: 0,87 έως 1,72, p=0,248).
Κλινικές μελέτες ελεγχόμενες με εικονικό φάρμακο διάρκειας 6 και 12 μηνών, έχουν δείξει ότι η τακτική χορήγηση Seretide 50/500 μικρογραμμάρια βελτιώνει την πνευμονική λειτουργία και μειώνει την δύσπνοια και την χρήση ανακουφιστικής θεραπείας.
Οι δοκιμές SCO40043 και SCO100250 ήταν τυχαιοποιημένες, διπλές τυφλές, παράλληλων ομάδων, πανομοιότυπες μελέτες, οι οποίες συνέκριναν τη δράση του Seretide 50/250 μικρογραμμάρια δις ημερησίως (δόση που δεν είναι εγκεκριμένη για τη θεραπεία της ΧΑΠ στην Ευρωπαϊκή Ένωση) με σαλμετερόλη 50 μικρογραμμάρια δις ημερησίως, ως προς την ετήσια συχνότητα μέτριων/σοβαρών παροξυσμών σε άτομα με ΧΑΠ που έχουν FEV1 μικρότερο από 50% της προβλεπόμενης τιμής και ιστορικό παροξυσμών. Μέτριοι/σοβαροί παροξυσμοί ορίσθηκαν ως επιδείνωση συμπτωμάτων που απαιτούσαν θεραπεία με κορτικοστεροειδή από το στόμα και/ ή αντιβιοτικά ή εισαγωγή του ασθενή σε νοσοκομείο.
Οι μελέτες είχαν μία περίοδο εισαγωγής 4 εβδομάδων, κατά τη διάρκεια της οποίας όλα τα άτομα έλαβαν φανερά σαλμετερόλη/προπιονική φλουτικαζόνη 50/250 για να τυποποιηθεί η φαρμακοθεραπεία της ΧΑΠ και να σταθεροποιηθεί η νόσος πριν την τυχαιοποίηση στην τυφλή αγωγή της μελέτης για 52 εβδομάδες. Τα άτομα τυχαιοποιήθηκαν 1:1 σε σαλμετερόλη/ προπιονική φλουτικαζόνη 50/250 (συνολικός ΙΤΤ n=776) ή σαλμετερόλη (συνολικό ΙΤΤ n=778). Πριν την περίοδο εισαγωγής, τα άτομα διέκοψαν προηγούμενες θεραπείας για ΧΑΠ εκτός από βρογχοδιασταλτικά βραχείας δράσης. Η ταυτόχρονη χρήση εισπνεόμενων βρογχοδιασταλτικών μακράς δράσης (β2 διεγέρτες και αντιχολινεργικά), συνδυασμών ιπρατρόπιου/σαλβουταμόλης, β2 διεγερτών από το στόμα και σκευασμάτων θεοφυλλίνης, δεν επιτράπηκαν κατά τη διάρκεια της περιόδου θεραπείας. Κορτικοστεροειδή από το στόμα και αντιβιοτικά επιτράπηκαν για την αντιμετώπιση παροξυσμών της ΧΑΠ με ειδικές οδηγίες για τη χρήση. Τα άτομα χρησιμοποίησαν σαλβουταμόλη σε κατ’ επίκληση βάση κατά τη διάρκεια των μελετών.
Τα αποτελέσματα και των δύο δοκιμών έδειξαν ότι η θεραπεία με Seretide 50/250 είχε ως αποτέλεσμα σημαντικά χαμηλότερο ετήσιο ρυθμό μέτριων/σοβαρών παροξυσμών ΧΑΠ συγκριτικά με την σαλμετερόλη (SCO40043: 1,06 και 1,53 ανά άτομο ετησίως, αντίστοιχα, αναλογία συχνότητας 0,70, 95% CI: 0,58 έως 0,83, p<0,001; SCO100250: 1,10 και 1,59 ανά άτομο ετησίως, αντίστοιχα, αναλογία συχνότητας 0,70, 95% CI: 0,58 έως 0,83, p<0,001). Τα ευρήματα για τα δευτερεύοντα καταληκτικά σημεία αποτελεσματικότητας (χρόνος για τον πρώτο μέτριο/σοβαρό παροξυσμό, ετήσια συχνότητα παροξυσμών που απαιτούν κορτικοστεροειδή από το στόμα και την προ δόσης πρωινή FEV1) ήταν σημαντικά υπέρ του Seretide 50/250 μικρογραμμάρια δις ημερησίως έναντι της σαλμετερόλης. Τα προφίλ των ανεπιθύμητων ενεργειών ήταν παρόμοια με εξαίρεση την υψηλότερη συχνότητα πνευμονίας και γνωστών τοπικών ανεπιθύμητων ενεργειών (καντιντίαση και δυσφωνία) στην ομάδα του Seretide 50/250 μικρογραμμάρια δις ημερησίως συγκριτικά με την σαλμετερόλη. Οι σχετιζόμενες με πνευμονία καταστάσεις αναφέρθηκαν σε 55 (7%) άτομα από την ομάδα του Seretide 50/250 μικρογραμμάρια δις ημερησίως και σε 25 (3%) από την ομάδα της σαλμετερόλης. Τα αυξημένα ποσοστά αναφορών πνευμονίας με το Seretide 50/250 μικρογραμμάρια δις ημερησίως φαίνεται να είναι παρόμοιου μεγέθους με την συχνότητα που αναφέρθηκε μετά από θεραπεία με Seretide 50/500 μικρογραμμάρια δις ημερησίως στην TORCH.
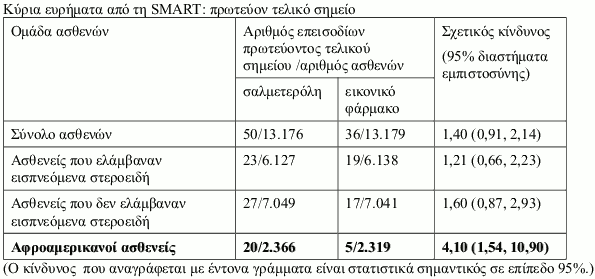
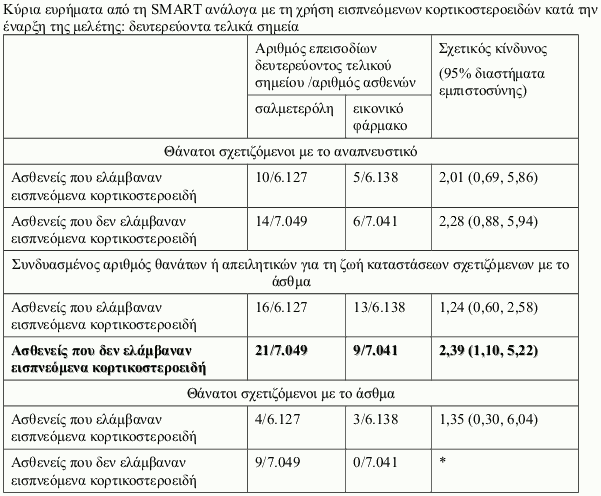
Μελέτη SMART (Salmeterol Multi-center Asthma Research Trial)
Η SMART ήταν μία πολυκεντρική, τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο, μελέτη παράλληλων ομάδων στις ΗΠΑ, διάρκειας 28-εβδομάδων, στην οποία τυχαιοποιήθηκαν 13.176 ασθενείς σε σαλμετερόλη (50 μικρογραμμάρια δύο φορές την ημέρα) και 13.179 ασθενείς σε εικονικό φάρμακο επιπρόσθετα της συνήθους αντιασθματικής αγωγής που ελάμβαναν. Στη μελέτη συμμετείχαν ασθενείς ηλικίας ≥12 ετών με άσθμα, οι οποίοι ελάμβαναν κατά τη δεδομένη χρονική στιγμή αντιασθματική θεραπεία (εκτός από β2 διεγέρτες μακράς δράσης). Η αρχική χρήση εισπνεόμενων κορτικοστεροειδών κατά την ένταξη στη μελέτη καταγράφηκε, δεν ήταν όμως απαραίτητη κατά τη διάρκεια της μελέτης. Το πρωτεύον τελικό σημείο στη SMART ήταν ο συνδυασμένος αριθμός θανάτων σχετιζόμενων με το αναπνευστικό και απειλητικών για τη ζωή καταστάσεων σχετιζόμενων με το αναπνευστικό.
Παιδιατρικός πληθυσμός
Στη μελέτη SAM101667, σε 158 παιδιά ηλικίας 6 έως 16 ετών με συμπτωματικό άσθμα, ο συνδυασμός σαλμετερόλης/προπιονικής φλουτικαζόνης είναι εξίσου αποτελεσματικός με το διπλασιασμό της δόσης της προπιονικής φλουτικαζόνης αναφορικά με τον έλεγχο των συμπτωμάτων και της πνευμονικής λειτουργίας. Αυτή η μελέτη δεν σχεδιάστηκε για τη διερεύνηση της επίδρασης στους παροξυσμούς.
Σε μία μελέτη διάρκειας 12 εβδομάδων σε παιδιά ηλικίας 4 έως 11 ετών [n=257] που αντιμετωπίστηκαν είτε με σαλμετερόλη/προπιονική φλουτικαζόνη 50/100 είτε με σαλμετερόλη 50 μικρογραμμάρια + προπιονική φλουτικαζόνη 100 μικρογραμμάρια δύο φορές την ημέρα, και τα δύο σκέλη θεραπείας εμφάνισαν 14% αύξηση της μέγιστης εκπνευστικής ροής καθώς επίσης και βελτιώσεις της βαθμολογίας συμπτωμάτων και της χρήσης φαρμάκου διάσωσης (σαλβουταμόλη). Δεν υπήρχαν διαφορές μεταξύ των 2 σκελών θεραπείας. Δεν υπήρχαν διαφορές ως προς τις παραμέτρους ασφάλειας μεταξύ των 2 σκελών θεραπείας.
Ο κύριος στόχος μίας δοκιμής διάρκειας 12 εβδομάδων σε παιδιά ηλικίας 4 έως 11 ετών [n=203] με εμμένον άσθμα τυχαιοποιημένα σε μία μελέτη παράλληλων ομάδων και τα οποία ήταν συμπτωματικά υπό εισπνεόμενο κορτικοστεροειδές, ήταν η ασφάλεια. Τα παιδιά έλαβαν είτε σαλμετερόλη/προπιονική φλουτικαζόνη (50/100 μικρογραμμάρια) είτε προπιονική φλουτικαζόνη (100 μικρογραμμάρια) μεμονωμένα δύο φορές την ημέρα. Δύο παιδιά που έλαβαν σαλμετερόλη/προπιονική φλουτικαζόνη και 5 παιδιά που έλαβαν προπιονική φλουτικαζόνη αποσύρθηκαν λόγω επιδείνωσης του άσθματος. Μετά από 12 εβδομάδες κανένα παιδί και από τα δύο σκέλη θεραπείας δεν είχε μη φυσιολογικά χαμηλή 24-ωρη απέκκριση κορτιζόλης στα ούρα. Δεν υπήρχαν λοιπές διαφορές ως προς το προφίλ ασφάλειας μεταξύ των σκελών θεραπείας.
Φαρμακοκινητική
Από φαρμακοκινητικής άποψης κάθε συστατικό μπορεί να εξετασθεί ξεχωριστά.
Σαλμετερόλη
Η σαλμετερόλη δρα τοπικά στους πνεύμονες και επομένως οι στάθμες της στο πλάσμα δεν είναι ενδεικτικές της θεραπευτικής της δράσης. Επιπλέον τα υπάρχοντα στοιχεία φαρμακοκινητικής της σαλμετερόλης είναι περιορισμένα λόγω τεχνικών δυσκολιών του προσδιορισμού της στο πλάσμα εξ αιτίας των χαμηλών συγκεντρώσεων της στο πλάσμα μετά από εισπνοές σε θεραπευτικές δόσεις (περίπου 200 picοgram/mL ή λιγότερο).
Προπιονική φλουτικαζόνη
Η απόλυτη βιοδιαθεσιμότητα μιας εφάπαξ δόσης εισπνεόμενης προπιονική φλουτικαζόνη σε υγιή άτομα ποικίλει μεταξύ περίπου 5 έως 11% της αναγραφόμενης δόσης ανάλογα με τη συσκευή εισπνοών που χρησιμοποιείται. Σε ασθενείς με άσθμα ή ΧΑΠ έχει παρατηρηθεί μικρότερος βαθμός συστηματικής έκθεσης σε εισπνεόμενη προπιονική φλουτικαζόνη.
Η συστηματική απορρόφηση λαμβάνει χώρα κυρίως μέσω των πνευμόνων και είναι αρχικά ταχεία και στη συνέχεια παρατεταμένη. Το υπόλοιπο της εισπνεόμενης δόσης μπορεί να καταπίνεται αλλά συνεισφέρει ελάχιστα στη συστηματική έκθεση λόγω χαμηλής υδατοδιαλυτότητας και προ- συστηματικού μεταβολισμού με αποτέλεσμα βιοδιαθεσιμότητα από του στόματος μικρότερη από 1%. Υπάρχει γραμμική αύξηση στη συστηματική έκθεση με την αύξηση της εισπνεόμενης δόσης.
Η κατανομή της προπιονικής φλουτικαζόνης χαρακτηρίζεται από υψηλή κάθαρση πλάσματος (1.150mL/min), μεγάλο όγκο κατανομής σε σταθεροποιημένη κατάσταση (περίπου 300 L) και τελική ημιπερίοδο ζωής περίπου 8 ώρες.
Η σύνδεση με τις πρωτεΐνες του πλάσματος είναι 91%.
Η προπιονική φλουτικαζόνη αποβάλλεται πολύ γρήγορα από τη συστηματική κυκλοφορία. H κύρια οδός αποβολής είναι ο μεταβολισμός σε έναν αδρανή μεταβολίτη του καρβοξυλικού οξέος από το ενζυμικό σύστημα CYP3A4 του κυττοχρώματος P450. Άλλοι μη ταυτοποιημένοι μεταβολίτες βρέθηκαν επίσης στα κόπρανα.
Η νεφρική κάθαρση της προπιονικής φλουτικαζόνης είναι αμελητέα. Λιγότερο από 5% της δόσης απεκκρίνεται στα ούρα, κυρίως σαν μεταβολίτες. Το κύριο μέρος της δόσης εκκρίνεται με τα κόπρανα σαν μεταβολίτες και αμετάβλητο φάρμακο.
Παιδιατρικός πληθυσμός
Σε μία ανάλυση φαρμακοκινητικής πληθυσμού, στην οποία χρησιμοποιήθηκαν δεδομένα από 9 ελεγχόμενες κλινικές μελέτες με διαφορετικές συσκευές (Diskus, inhaler καθορισμένων δόσεων), στις οποίες συμπεριλήφθηκαν 350 ασθενείς με άσθμα ηλικίας 4 έως 77 ετών (174 ασθενείς ηλικίας 4 έως 11 ετών) παρατηρήθηκε υψηλότερη συστηματική έκθεση στην προπιονική φλουτικαζόνη μετά από θεραπεία με Seretide Diskus 50/100 σε σύγκριση με το Diskus 100 με προπιονική φλουτικαζόνη.
Γεωμετρική Μέση Αναλογία [90% CI] για τη Σύγκριση Σαλμετερόλης/προπιονικής φλουτικαζόνης έναντι προπιονικής φλουτικαζόνης Diskus σε Παιδιατρικούς Πληθυσμούς και Πληθυσμούς Εφήβων/Ενηλίκων
| Θεραπεία (θεραπεία υπό δοκιμή έναντι θεραπείας ελέγχου) | Πληθυσμός | AUC | Cmax |
|---|---|---|---|
| Diskus Σαλμετερόλη/ προπιονική φλουτικαζόνη 50/100, Diskus προπιονική φλουτικαζόνη 100 | Παιδιά (4 έως 11 ετών) | 1,20 [1,06 – 1,37] | 1,25 [1,11 – 1,41] |
| Diskus Σαλμετερόλη/ προπιονική φλουτικαζόνη 50/100, Diskus 100 προπιονική φλουτικαζόνη | Έφηβοι/Ενήλικες (≥12 ετών) | 1,52 [1,08 – 2,13] | 1,52 [1,08 – 2,16] |
Η επίδραση της θεραπείας διάρκειας 21 ημερών με Seretide Inhaler 25/50 μικρογραμμάρια (2 εισπνοές δύο φορές την ημέρα με ή χωρίς αεροθάλαμο) ή με Seretide Diskus 50/100 μικρογραμμάρια (1 εισπνοή δύο φορές την ημέρα) αξιολογήθηκε σε 31 παιδιά ηλικίας 4 έως 11 ετών με ήπιο άσθμα. Η συστηματική έκθεση στη σαλμετερόλη ήταν παρόμοια για το Seretide Inhaler, το Seretide Inhaler με αεροθάλαμο και το Seretide Diskus (126 pg hr/mL [95% CI: 70, 225], 103 pg hr/mL [95% CI: 54, 200] και 110 pg hr/mL [95% CI: 55, 219], αντίστοιχα). Η συστηματική έκθεση στην προπιονική φλουτικαζόνη ήταν παρόμοια για το Seretide Inhaler με αεροθάλαμο (107 pg hr/mL [95% CI: 45,7, 252,2]) και το Seretide Diskus (138 pg hr/mL [95% CI: 69,3, 273,2]), αλλά χαμηλότερη για το Seretide Inhaler (24 pg hr/mL [95% CI: 9,6, 60,2]).
Προκλινικά δεδομένα για την ασφάλεια
Τα μόνα ζητήματα ασφάλειας για ανθρώπινη χρήση τα οποία απορρέουν από μελέτες σε ζώα με ξεχωριστή χορήγηση σαλμετερόλης και προπιονικής φλουτικαζόνης, ήταν επιδράσεις που συνδέονταν με μεγιστοποίηση των φαρμακολογικών δράσεων.
Σε μελέτες αναπαραγωγής στα ζώα, τα γλυκοκορτικοστεροειδή απεδείχθη ότι προκαλούν διαμαρτίες της διάπλασης (υπερωϊοσχιστία, διαμαρτίες της σκελετικής διάπλασης). Παρόλα αυτά, τα αποτελέσματα των πειραμάτων στα ζώα δεν φαίνεται να σχετίζονται με τον άνθρωπο, στις συνιστώμενες δόσεις. Σε μελέτες σε ζώα με σαλμετερόλη παρατηρήθηκε εμβρυοτοξικότητα μόνο σε υψηλά επίπεδα έκθεσης. Μετά από συγχορήγηση, βρέθηκε αυξημένη συχνότητα μετατόπισης της ομφαλικής αρτηρίας και ατελής οστεοποίηση του ινιακού οστού, σε αρουραίους, σε δόσεις που σχετίζονταν με γνωστές διαμαρτίες της διάπλασης που προκαλούνται από τα γλυκοκορτικοστεροειδή.
Καρκινογένεση, μεταλλάξεις, στείρωση
Γονιμότητα
Δεν υπάρχουν δεδομένα σε ανθρώπους. Ωστόσο, μελέτες σε ζώα δεν έδειξαν επίδραση της σαλμετερόλης ή της προπιονικής φλουτικαζόνης στη γονιμότητα.
Ενεργά συστατικά
|
6EW8Q962A5 - SALMETEROL XINAFOATE
|
|
O2GMZ0LF5W - FLUTICASONE PROPIONATE
|
Σχετικό SPC
Seretide Diskus 50/100 μικρογραμμάρια/δόση κόνεως για εισπνοή σε δόσεις.
Seretide Diskus 50/250 μικρογραμμάρια/δόση κόνεως για εισπνοή σε δόσεις.
Seretide Diskus 50/500 μικρογραμμάρια/δόση κόνεως για εισπνοή σε δόσεις.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.
ΠΧΠ : SERETIDE Diskus Pwd. Inh.