Φαρμακοδυναμική
Φαρμακοθεραπευτική κατηγορία: Φάρμακα για τις αποφρακτικές νόσους των αεραγωγών, λοιπά συστηματικά φάρμακα για τις αποφρακτικές νόσους των αεραγωγών
Κωδικός ATC: R03DX10
Μηχανισμός δράσης
Η μπενραλιζουμάμπη είναι ένα αντι-ηωσινοφιλικό, ανθρωποποιημένο μη φουκοζυλιωμένο, μονοκλωνικό αντίσωμα (ανοσοσφαιρίνη G1 (IgG1), κάππα). Συνδέεται ειδικά με την άλφα υπομονάδα του ανθρώπινου υποδοχέα της ιντερλευκίνης-5 (IL-5Rα). Ο υποδοχέας IL-5 εκφράζεται ειδικά στην επιφάνεια των ηωσινοφίλων και βασεοφίλων. Η απουσία φουκόζης στην περιοχή Fc της μπενραλιζουμάμπης έχει ως αποτέλεσμα υψηλή συγγένεια για τους FcɣRIII υποδοχείς σε ανοσοδραστικά κύτταρα, όπως τα φυσικά κύτταρα φονείς (ΝΚ). Αυτή οδηγεί σε απόπτωση των ηωσινοφίλων και βασεοφίλων διά μέσου ενισχυμένης εξαρτώμενης από το αντίσωμα κυτταρομεσολαβούμενης κυτταροτοξικότητας (ADCC), η οποία μειώνει την ηωσινοφιλική φλεγμονή.
Φαρμακοδυναμικές επιδράσεις
Επίδραση στα ηωσινόφιλα αίματος
Η θεραπεία με μπενραλιζουμάμπη έχει ως αποτέλεσμα σχεδόν πλήρη ελλάτωση των ηωσινοφίλων αίματος εντός 24 ωρών μετά την πρώτη δόση, η οποία διατηρείται καθ' όλη τη θεραπεία. Η ελάττωση των ηωσινοφίλων αίματος συνοδεύεται από μία μείωση στον ορό των πρωτεϊνών των ειδικών κοκκίων των ηωσινοφίλων, ηωσινοφιλική νευροτοξίνη (EDN) και ηωσινοφιλική κατιονική πρωτεΐνη (ECP) και μία μείωση των βασεοφίλων αίματος.
Επίδραση στα ηωσινόφιλα στον βλεννογόνο των αεραγωγών
Η επίδραση της μπενραλιζουμάμπης στα ηωσινόφιλα στον βλεννογόνο των αεραγωγών σε ασθενείς με άσθμα με αυξημένο αριθμό ηωσινοφίλων πτυέλων (τουλάχιστον 2,5%) αξιολογήθηκε σε μία 12-εβδομάδων, φάσης 1, τυχαιοποιημένη, διπλά-τυφλή, ελεγχόμενη με εικονικό φάρμακο κλινική μελέτη με μπενραλιζουμάμπη100 ή 200 mg υποδόρια. Σε αυτή τη μελέτη υπήρξε μία διάμεση μείωση από την έναρξη των ηωσινοφίλων στον βλεννογόνο των αεραγωγών της τάξης του 96% στην ομάδα που έλαβε θεραπεία με μπενραλιζουμάμπη σε σύγκριση με μείωση κατά 47% στην ομάδα του εικονικού φαρμάκου (p=0,039).
Κλινική αποτελεσματικότητα
Η αποτελεσματικότητα της μπενραλιζουμάμπης αξιολογήθηκε σε 3 τυχαιοποιημένες, διπλά-τυφλές, παράλληλων ομάδων, ελεγχόμενες με εικονικό φάρμακο κλινικές δοκιμές διάρκειας μεταξύ 28 έως 56 εβδομάδων, σε ασθενείς ηλικίας 12 έως 75 ετών.
Σε αυτές τις μελέτες, η μπενραλιζουμάμπη χορηγήθηκε σε δόση των 30 mg μία φορά κάθε 4 εβδομάδες για τις πρώτες 3 δόσεις και στη συνέχεια κάθε 4 ή 8 εβδομάδες μετέπειτα ως επιπρόσθετη στη βασική θεραπεία και αξιολογήθηκε σε σύγκριση με το εικονικό φάρμακο.
Στις δύο μελέτες παροξύνσεων, SIROCCO (Μελέτη 1) και CALIMA (Μελέτη 2), εντάχθηκαν συνολικά 2.510 ασθενείς με σοβαρό μη ελεγχόμενο άσθμα, 64% γυναίκες, με μέση ηλικία 49 ετών. Οι ασθενείς είχαν ιστορικό 2 ή περισσότερων παροξύνσεων άσθματος που να χρήζουν από στόματος ή συστηματική θεραπεία με κορτικοστεροειδή (μέσος όρος 3) τους τελευταίους 12 μήνες, βαθμολογία στο Ερωτηματολόγιο Ελέγχου του Άσθματος 6 (ACQ-6) 1,5 ή περισσότερο κατά τη διαλογή και μειωμένη αναπνευστική λειτουργία κατά την έναρξη (μέσος προβλεπόμενος προ-βρογχοδιασταλτικός ταχέως εκπνεόμενος όγκος σε 1 δευτερόλεπτο [FEV1] 57,5%), παρά την τακτική θεραπεία με υψηλές δόσεις εισπνεόμενων κορτικοστεροειδών (ICS) (Μελέτη 1) ή με μέτριες ή υψηλές δόσεις ICS (Μελέτη 2) και μακράς δράσης β-αγωνιστή (LABA), τουλάχιστον ένας πρόσθετος ελεγκτής χορηγήθηκε στο 51% και 41% αυτών των ασθενών, αντίστοιχα.
Για τη μελέτη της μείωσης των από στόματος κορτικοστεροειδών (OCS), ZONDA (Μελέτη 3) εντάχθηκαν συνολικά 220 ασθενείς με άσθμα (61% γυναίκες, μέση ηλικία 51 ετών), που λάμβαναν θεραπεία καθημερινά με OCS (8 έως 40 mg ημερησίως, διάμεση τιμή 10 mg) επιπροσθέτως της τακτικής χρήσης υψηλών δόσεων ICS και LABA με τουλάχιστον έναν πρόσθετο ελεγκτή για τη διατήρηση του ελέγχου του άσθματος στο 53% των περιπτώσεων. Η μελέτη περιελάμβανε μια προκαταρκτική περίοδο 8 εβδομάδων, κατά τη διάρκεια της οποίας τα OCS τιτλοποιήθηκαν στην ελάχιστη αποτελεσματική δόση χωρίς απώλεια του ελέγχου του άσθματος. Οι ασθενείς είχαν αριθμό ηωσινοφίλων αίματος ≥150 κύτταρα/μl και ιστορικό τουλάχιστον μίας παρόξυνσης τους τελευταίους 12 μήνες.
Ενώ μελετήθηκαν 2 σχήματα δόσης στις Μελέτες 1, 2 και 3, το συνιστώμενο σχήμα δόσης είναι μπενραλιζουμάμπη χορηγούμενη κάθε 4 εβδομάδες για τις πρώτες 3 δόσεις και στη συνέχεια κάθε 8 εβδομάδες μετέπειτα (βλέπε παράγραφο 4.2), καθώς δεν παρατηρήθηκε πρόσθετο όφελος από τη συχνότερη χορηγήση δόσεων. Τα αποτελέσματα που συνοψίζονται παρακάτω είναι εκείνα για το συνιστώμενο σχήμα δόσης.
Μελέτες παροξύνσεων
Το πρωτεύον καταληκτικό σημείο ήταν ο ετήσιος ρυθμός κλινικά σημαντικών παροξύνσεων άσθματος σε ασθενείς με αριθμό ηωσινοφίλων αίματος κατά την έναρξη ≥300 κύτταρα/μl, οι οποίοι λάμβαναν υψηλές δόσεις ICS και LABA. Η κλινικά σημαντική παρόξυνση άσθματος ορίστηκε ως επιδείνωση του άσθματος που απαιτεί τη χρήση από στόματος/συστηματικών κορτικοστεροειδών για τουλάχιστον 3 ημέρες και/ή μετάβαση σε τμήμα επειγόντων περιστατικών που απαιτεί τη χρήση από στόματος/συστηματικών κορτικοστεροειδών και/ή νοσηλεία. Για τους ασθενείς υπό συντήρηση με OCS, αυτή ορίστηκε ως μια προσωρινή αύξηση στα σταθερά από στόματος/συστηματικά κορτικοστεροειδή για τουλάχιστον 3 ημέρες ή μία ενέσιμη δόση εφόδου κορτικοστεροειδών.
Σε αμφότερες τις μελέτες, οι ασθενείς που έλαβαν μπενραλιζουμάμπη εμφάνισαν σημαντικές μειώσεις των ετήσιων ρυθμών παροξύνσεων σε σύγκριση με το εικονικό φάρμακο σε ασθενείς με ηωσινόφιλα αίματος ≥300 κύτταρα/μl. Επιπλέον, η μεταβολή από την έναρξη του μέσου FEV1 κατέδειξε όφελος ήδη από τις 4 εβδομάδες, το οποίο διατηρήθηκε μέχρι το τέλος της θεραπείας (Πίνακας 2).
Μειώσεις στους ρυθμούς παροξύνσεων παρατηρήθηκαν ανεξάρτητα από τον αριθμό ηωσινοφίλων κατά την έναρξη, ωστόσο, η αύξηση του αριθμού ηωσινοφίλων κατά την έναρξη αναγνωρίστηκε ως δυνητικός προβλεπτικός παράγοντας της βελτιωμένης ανταπόκρισης στη θεραπεία, ιδιαίτερα για τον FEV1.
Πίνακας 2. Αποτελέσματα του ετήσιου ρυθμού παροξύνσεων και της πνευμονικής λειτουργίας στο τέλος της θεραπείας της Δοκιμής 1 και 2 ανάλογα με τον αριθμό ηωσινοφίλων:
| Μελέτη 1 | Μελέτη 2 | |||
|---|---|---|---|---|
| Μπενραλιζουμάμπη | Εικονικό φάρμακο | Μπενραλιζουμάμπη | Εικονικό φάρμακο | |
| Αριθμός ηωσινοφίλων αίματος ≥300 κύτταρα/μlα | n=267 | n=267 | n=239 | n=248 |
| Κλινικά σημαντικές παροξύνσεις | ||||
| Ρυθμός | 0,74 | 1,52 | 0,73 | 1,01 |
| Διαφορά | -0,78 | -0,29 | ||
| Πηλίκο ρυθμού (95% CI) | 0,49 (0,37, 0,64) | 0,72 (0,54, 0,95) | ||
| p-τιμή | <0,001 | 0,019 | ||
| Προ-βρογχοδιαστολή FEV1 (l) | ||||
| Μέση τιμή κατά την έναρξη | 1,660 | 1,654 | 1,758 | 1,815 |
| Βελτίωση από την έναρξη | 0,398 | 0,239 | 0,330 | 0,215 |
| Διαφορά (95% CI) | 0,159 (0,068, 0,249) | 0,116 (0,028, 0,204) | ||
| p-τιμή | 0,001 | 0,010 | ||
| Αριθμός ηωσινοφίλων αίματος <300 κύτταρα/μlβ | n=131 | n=140 | n=125 | n=122 |
| Κλινικά σημαντικές παροξύνσεις | ||||
| Ρυθμός | 1,11 | 1,34 | 0,83 | 1,38 |
| Διαφορά | -0,23 | -0,55 | ||
| Πηλίκο ρυθμού (95% CI) | 0,83 (0,59, 1,16) | 0,60 (0,42, 0,86) | ||
| Προ-βρογχοδιαστολή FEV1 (l) | ||||
| Μέση μεταβολή | 0,248 | 0,145 | 0,140 | 0,156 |
| Διαφορά (95% CI) | 0,102 (-0,003, 0,208) | -0,015 (-0,127, 0,096) | ||
α Πληθυσμός με πρόθεση για θεραπεία (ασθενείς υπό υψηλές δόσεις ICS και ηωσινόφιλα αίματος ≥300 κύτταρα/μl).
β Χωρίς ισχύ για ανίχνευση διαφοράς της θεραπείας σε ασθενείς με ηωσινόφιλα αίματος <300 κύτταρα/μl.
Στον συνδυασμό των Μελετών 1 και 2, υπήρξε μια αριθμητικά μεγαλύτερη μείωση του ρυθμού παροξύνσεων και μεγαλύτερες βελτιώσεις στον FEV1 με αύξηση των ηωσινοφίλων αίματος κατά την έναρξη.
Ο ρυθμός των παροξύνσεων που απαιτούν νοσηλεία και/ή μετάβαση σε τμήμα επειγόντων περιστατικών σε ασθενείς που έλαβαν μπενραλιζουμάμπη σε σύγκριση με το εικονικό φάρμακο για τη Μελέτη 1 ήταν 0,09 έναντι 0,25 (πηλίκο ρυθμού 0,37, 95% CI: 0,20, 0,67, p=<0,001) και για τη Μελέτη 2 ήταν 0,12 έναντι 0,10 (πηλίκο ρυθμού 1,23, 95% CI: 0,64, 2,35, p=0,538). Στη Μελέτη 2, υπήρξαν πολύ λίγα συμβάντα στο σκέλος της θεραπείας με εικονικό φάρμακο για να εξαχθούν συμπεράσματα για τις παροξύνσεις που χρήζουν νοσηλείας ή μετάβασης σε τμήμα επειγόντων περιστατικών.
Σε αμφότερες τις Μελέτες 1 και 2, οι ασθενείς που έλαβαν μπενραλιζουμάμπη εμφάνισαν στατιστικά σημαντικές μειώσεις στα συμπτώματα άσθματος (Συνολική Βαθμολογία Άσθματος) σε σύγκριση με ασθενείς που έλαβαν εικονικό φάρμακο. Παρόμοια βελτίωση υπέρ της μπενραλιζουμάμπης παρατηρήθηκε για το ACQ-6 και το Τυποποιημένο Ερωτηματολόγιο για την Ποιότητα Ζωής του Άσθματος για 12 Έτη και άνω (AQLQ+12) (Πίνακας 3).
Πίνακας 3. Διαφορά θεραπείας στη μέση μεταβολή από την έναρξη στη συνολική βαθμολογία συμπτωμάτων άσθματος, ACQ-6 και AQLQ+12 στο τέλος της θεραπείας - Ασθενείς υπό υψηλές δόσεις ICS και ηωσινόφιλα αίματος ≥300 κύτταρα/μL:
| Μελέτη 1 | Μελέτη 2 | |||
|---|---|---|---|---|
| Μπενραλιζουμάμπη (nα=267) | Εικονικό φάρμακο (nα=267) | Μπενραλιζουμάμπη (nα=239) | Εικονικό φάρμακο (nα=248) | |
| Συνολική βαθμολογία συμπτωμάτων άσθματοςβ | ||||
| Μέση τιμή κατά την έναρξη | 2,68 | 2,74 | 2,76 | 2,71 |
| Βελτίωση από την έναρξη | -1,30 | -1,04 | -1,40 | -1,16 |
| Διαφορά (95% CI) | -0,25 (-0,45, -0,06) | -0,23 (-0,43, -0,04) | ||
| p-τιμή | 0,012 | 0,019 | ||
| ACQ-6 | ||||
| Μέση τιμή κατά την έναρξη | 2,81 | 2,90 | 2,80 | 2,75 |
| Βελτίωση από την έναρξη | -1,46 | -1,17 | -1,44 | -1,19 |
| Διαφορά (95% CI) | -0,29 (-0,48, -0,10) | -0,25 (-0,44, -0,07) | ||
| AQLQ+12 | ||||
| Μέση τιμή κατά την έναρξη | 3,93 | 3,87 | 3,87 | 3,93 |
| Βελτίωση από την έναρξη | 1,56 | 1,26 | 1,56 | 1,31 |
| Διαφορά (95% CI) | 0,30 (0,10, 0,50) | 0,24 (0,04, 0,45) | ||
α Ο αριθμός των ασθενών (n) ποικίλλει ελαφρά λόγω του αριθμού των ασθενών, για τους οποίους υπήρχαν διαθέσιμα στοιχεία για κάθε μεταβλητή. Τα αποτελέσματα εμφανίζονται με βάση τα τελευταία διαθέσιμα δεδομένα για κάθε μεταβλητή.
β Βαθμολογία συμπτωμάτων άσθματος: συνολική βαθμολογία από 0 (ελάχιστο) έως 6 (μέγιστο), πρωινές και βραδινές βαθμολογίες συμπτωμάτων άσθματος από 0 (ελάχιστο) έως 3 (μέγιστο) συμπτώματα. Οι ατομικές πρωινές και βραδινές βαθμολογίες ήταν παρόμοιες.
Αναλύσεις υποομάδων με βάση το ιστορικό προηγούμενων παροξύνσεων:
Η ανάλυση υποομάδων από τις Μελέτες 1 και 2 προσδιόρισε ασθενείς με μεγαλύτερο προηγούμενο ιστορικό παροξύνσεων ως δυνητικό παράγοντα πρόβλεψης βελτιωμένης ανταπόκρισης στη θεραπεία. Όταν λαμβάνεται υπόψη μόνο ή σε συνδυασμό με τον αριθμό ηωσινοφίλων αίματος κατά την έναρξη, αυτοί οι παράγοντες μπορούν να προσδιορίσουν περαιτέρω τους ασθενείς που μπορεί να επιτύχουν μεγαλύτερη ανταπόκριση από τη θεραπεία με μπενραλιζουμάμπη (Πίνακας 4).
Πίνακας 4. Ρυθμός παρόξυνσης και πνευμονική λειτουργία (FEV1) στο τέλος της θεραπείας με τον αριθμό των παροξύνσεων κατά το προηγούμενο έτος, - Ασθενείς υπό υψηλές δόσεις ICS και ηωσινόφιλα αίματος ≥300 κύτταρα/μL:
| Μελέτη 1 | Μελέτη 2 | |||
|---|---|---|---|---|
| Μπενραλιζουμάμπη (N=267) | Εικονικό φάρμακο (N=267) | Μπενραλιζουμάμπη (N=239) | Εικονικό φάρμακο (N=248) | |
| 2 παροξύνσεις στην έναρξη | ||||
| n | 164 | 149 | 144 | 151 |
| Ρυθμός παρόξυνσης | 0,57 | 1,04 | 0,63 | 0,62 |
| Διαφορά | -0,47 | 0,01 | ||
| Πηλίκο ρυθμού (95% CI) | 0,55 (0,37, 0,80) | 1,01 (0,70, 1,46) | ||
| Μέση μεταβολή προ-βρογχοδιαστολής FEV1 | 0,343 | 0,230 | 0,266 | 0,236 |
| Διαφορά (95% CI) | 0,113 (-0,002, 0,228) | 0,029 (-0,079, 0,137) | ||
| 3 ή περισσότερες παροξύνσεις στην έναρξη | ||||
| n | 103 | 118 | 95 | 97 |
| Ρυθμός παρόξυνσης | 0,95 | 2,23 | 0,82 | 1,65 |
| Διαφορά | -1,28 | -0,84 | ||
| Πηλίκο ρυθμού (95% CI) | 0,43 (0,29, 0,63) | 0,49 (0,33, 0,74) | ||
| Μέση μεταβολή προ-βρογχοδιαστολής FEV1 | 0,486 | 0,251 | 0,440 | 0,174 |
| Διαφορά (95% CI) | 0,235 (0,088, 0,382) | 0,265 (0,115, 0,415) | ||
Μελέτη μείωσης της δόσης του από στόματος κορτικοστεροειδούς
H ZONDA (Μελέτη 3), μια ελεγχόμενη με εικονικό φάρμακο μελέτη, και η PONENTE (Μελέτη 6), μια μονού σκέλους, ανοιχτής επισήμανσης μελέτη, αξιολόγησαν την επίδραση της μπενραλιζουμάμπης στη μείωση της χρήσης OCS συντήρησης.
Στη Μελέτη 3 το πρωτεύον καταληκτικό σημείο ήταν η επί τοις εκατό μείωση από την έναρξη της τελικής δόσης των OCS κατά τη διάρκεια των εβδομάδων 24 έως 28, διατηρώντας παράλληλα τον έλεγχο του άσθματος. Ο Πίνακας 5 συνοψίζει τα αποτελέσματα της μελέτης για τη Μελέτη 3.
Πίνακας 5. Επίδραση της μπενραλιζουμάμπης στη μείωση της δόσης των από στόματος κορτικοστεροειδών (OCS), Μελέτη 3:
| Μπενραλιζουμάμπη (N=73) | Εικονικό φάρμακο (N=75) | |
|---|---|---|
| Έλεγχος αθροίσματος διατάξεων του Wilcoxon (μέθοδος πρωτεύουσας ανάλυσης) | ||
| Διάμεση % μείωση στην ημερήσια δόση OCS από την έναρξη (95% CI) | 75 (60, 88) | 25 (0, 33) |
| p-τιμή ελέγχου αθροίσματος διατάξεων του Wilcoxon | <0,001 | |
| Μοντέλο αναλογικών πιθανοτήτων (ανάλυση ευαισθησίας) | ||
| Επί τοις εκατό μείωση των OCS από την έναρξη στην Εβδομάδα 28 | ||
| ≥90% μείωση | 27 (37%) | 9 (12%) |
| ≥75% μείωση | 37 (51%) | 15 (20%) |
| ≥50% μείωση | 48 (66%) | 28 (37%) |
| >0% μείωση | 58 (79%) | 40 (53%) |
| Καμία μεταβολή ή καμία μείωση των OCS | 15 (21%) | 35 (47%) |
| Λόγος πιθανοτήτων (95% CI) | 4,12 (2,22, 7,63) | |
| Μείωση της ημερήσιας δόσης OCS σε 0 mg/ημέρα* | 22 (52%) | 8 (19%) |
| Λόγος πιθανοτήτων (95% CI) | 4,19 (1,58, 11,12) | |
| Μείωση της ημερήσιας δόσης OCS σε ≤5 mg/ημέρα | 43 (59%) | 25 (33%) |
| Λόγος πιθανοτήτων (95% CI) | 2,74 (1,41, 5,31) | |
| Ρυθμός παρόξυνσης | 0,54 | 1,83 |
| Πηλίκο ρυθμού (95% CI) | 0,30 (0,17, 0,53) | |
| Ρυθμός παρόξυνσης που χρήζει νοσηλείας/μετάβασης σε τμήμα επειγόντων περιστατικών | 0,02 | 0,32 |
| Πηλίκο ρυθμού (95% CI) | 0,07 (0,01, 0,63) | |
* Μόνο οι ασθενείς με βελτιστοποιημένη δόση OCS 12,5 mg ή λιγότερο κατά την έναρξη ήταν επιλέξιμοι για να επιτύχουν 100% μείωση της δόσης OCS κατά τη διάρκεια της μελέτης.
Η αναπνευστική λειτουργία, η βαθμολογία συμπτωμάτων άσθματος, τα ACQ-6 και AQLQ+12 αξιολογήθηκαν επίσης στη Μελέτη 3 και κατέδειξαν αποτελέσματα παρόμοια με εκείνα στις Μελέτες 1 και 2.
Στη Μελέτη 6 εντάχθηκαν 598 ενήλικες ασθενείς με σοβαρό άσθμα (αριθμός ηωσινόφιλων αίματος ≥150 κύτταρα/μl κατά την ένταξη ή ≥300 κύτταρα/μl τους τελευταίους 12 μήνες εάν ο αριθμός κατά την ένταξη στη μελέτη ήταν <150 κύτταρα/μl) που ήταν εξαρτώμενοι από κορτικοστεροειδή από στόματος. Τα πρωτεύοντα καταληκτικά σημεία ήταν το ποσοστό των ασθενών που απέκλεισαν το OCS διατηρώντας τον έλεγχο του άσθματος και το ποσοστό των ασθενών που πέτυχαν τελική δόση OCS μικρότερη ή ίση με 5 mg διατηρώντας παράλληλα τον έλεγχο του άσθματος και λαμβάνοντας υπόψη τη λειτουργία των επινεφριδίων. Το ποσοστό των ασθενών που απέκλεισαν το OCS συντήρησης ήταν 62,9%. Το ποσοστό των ασθενών που πέτυχαν δόση OCS μικρότερη ή ίση με 5 mg (διατηρώντας παράλληλα τον έλεγχο του άσθματος και χωρίς περιορισμό από τη λειτουργία των επινεφριδίων) ήταν 81,9%. Οι επιδράσεις στη μείωση του OCS ήταν παρόμοιες ανεξάρτητα από τον αριθμό ηωσινόφιλων αίματος κατά την ένταξη στη μελέτη (συμπεριλαμβανομένων των ασθενών με ηωσινόφιλα αίματος <150 κύτταρα/μl) και διατηρήθηκαν για μια επιπρόσθετη περίοδο 24 έως 32 εβδομάδων. Το ετήσιο ποσοστό παροξύνσεων στη Μελέτη 6 ήταν συγκρίσιμο με αυτό που αναφέρθηκε σε προηγούμενες δοκιμές.
Μελέτες μακροχρόνιας επέκτασης
Η μακροχρόνια αποτελεσματικότητα και ασφάλεια της μπενραλιζουμάμπης αξιολογήθηκαν σε μια μελέτη φάσης 3, η BORA (Μελέτη 4) ήταν μία μελέτη επέκτασης προηγούμενων μελετών διάρκειας 56 εβδομάδων. Στη μελέτη εντάχθηκαν 2.123 ασθενείς, 2.037 ενήλικες και 86 έφηβοι ασθενείς (ηλικίας 12 ετών και άνω) από τις Μελέτες 1, 2 και 3. Η Μελέτη 4 αξιολόγησε τη μακροχρόνια επίδραση της μπενραλιζουμάμπης στον ετήσιο ρυθμό παροξύνσεων, την αναπνευστική λειτουργία, τη βαθμολογία στα ερωτηματολόγια ACQ-6 και AQLQ+12 και τη διατήρηση της μείωσης των OCS στα 2 σχήματα δόσης που μελετήθηκαν στις προηγηθείσες μελέτες.
Στο συνιστώμενο σχήμα δόσης, η μείωση του ετήσιου ρυθμού παροξύνσεων που παρατηρήθηκε στις ελεγχόμενες με εικονικό φάρμακο προηγηθείσες Μελέτες 1 και 2 (σε ασθενείς με αριθμό ηωσινοφίλων αίματος κατά την έναρξη ≥ 300 κύτταρα/μl, οι οποίοι λάμβαναν υψηλή δόση ICS) διατηρήθηκε κατά τη διάρκεια του δεύτερου έτους της θεραπείας (Πίνακας 6). Σε ασθενείς, οι οποίοι έλαβαν μπενραλιζουμάμπη στις προηγηθείσες Μελέτες 1 και 2, το 73% ήταν ελεύθερο παροξύνσεων στη Μελέτη 4.
Πίνακας 6. Παροξύνσεις κατά την περίοδο επέκτασης της θεραπείαςα:
| Εικονικό φάρμακοβ (N=338) | Μπενραλιζουμάμπη (N=318) | |||
|---|---|---|---|---|
| Μελέτη 1 & 2 | Μελέτη 1 & 2 | Μελέτη 4 | Μελέτη 1, 2 & 4γ | |
| Ρυθμός | 1,23 | 0,65 | 0,48 | 0,56 |
α Ασθενείς που εντάχθηκαν στη Μελέτη 4 από τις προηγηθείσες Μελέτες 1 και 2 με αριθμό ηωσινοφίλων αίματος κατά την έναρξη ≥300 κύτταρα/μl, οι οποίοι λάμβαναν υψηλή δόση ICS.
β Ασθενείς υπό εικονικό φάρμακο στις Μελέτες 1 και 2 συμπεριλαμβάνονται έως το τέλος της προηγηθείσας μελέτης (Εβδομάδα 48 στη Μελέτη 1, Εβδομάδα 56 στη Μελέτη 2).
γ Συνολική διάρκεια της θεραπείας: 104-112 εβδομάδες
Διατήρηση της επίδρασης στην αναπνευστική λειτουργία, τη βαθμολογία ACQ-6 και τη βαθμολογία AQLQ+12 παρατηρήθηκε σε όλη τη διάρκεια της Μελέτης 4 (Πίνακας 7).
Πίνακας 7. Μεταβολή από την έναρξη για την αναπνευστική λειτουργία, τη βαθμολογία ACQ-6 και τη βαθμολογία AQLQ+12α:
| Μελέτη 1 & 2 Έναρξηβ | Μελέτη 1 & 2 EOTγ | Μελέτη 4 EOTδ | |
|---|---|---|---|
| Προ-βρογχοδιαστολή FEV1 (l) | |||
| n | 318 | 305 | 290 |
| Μέση τιμή κατά την έναρξη (SD) | 1,741 (0,621) | -- | -- |
| Μεταβολή από την έναρξη (SD)ε | -- | 0,343 (0,507) | 0,404 (0,555) |
| ACQ-6 | |||
| n | 318 | 315 | 296 |
| Μέση τιμή κατά την έναρξη (SD) | 2,74 (0,90) | -- | -- |
| Μεταβολή από την έναρξη (SD)ε | -- | -1,44 (1,13) | -1,47 (1,05) |
| AQLQ+12 | |||
| n | 307 | 306 | 287 |
| Μέση τιμή κατά την έναρξη (SD) | 3,90 (0,99) | -- | -- |
| Μεταβολή από την έναρξη (SD)ε | -- | 1,58 (1,23) | 1,61 (1,21) |
n = αριθμός ασθενών με δεδομένα σε χρονικό σημείο. SD = τυπική απόκλιση
α Αριθμός ηωσινοφίλων αίματος κατά την έναρξη ≥ 300 cells/μl και λήψη υψηλής δόσης ICS: η μπενραλιζουμάμπη χορηγήθηκε στο συνιστώμενο σχήμα δόσης.
β Η ολοκληρωμένη ανάλυση των Μελετών 1 και 2 κατά την έναρξη περιλαμβάνει ενήλικες και εφήβους.
γ Ολοκληρωμένη ανάλυση στο Τέλος της Θεραπείας (EOT) της Μελέτης 1 (Εβδομάδα 48) και της Μελέτης 2 (Εβδομάδα 56).
δ Το EOT για τη Μελέτη 4 ήταν η Εβδομάδα 48 (το τελευταίο χρονικό σημείο των δεδομένων για ενήλικες και εφήβους).
ε Η έναρξη προηγείται της θεραπείας με μπενραλιζουμάμπη στη Μελέτη 1 και 2.
Η αποτελεσματικότητα στη Μελέτη 4 αξιολογήθηκε επίσης σε ασθενείς με αριθμό ηωσινοφίλων αίματος κατά την έναρξη <300 κύτταρα/μl και ήταν συνεπής με τις Μελέτες 1 και 2.
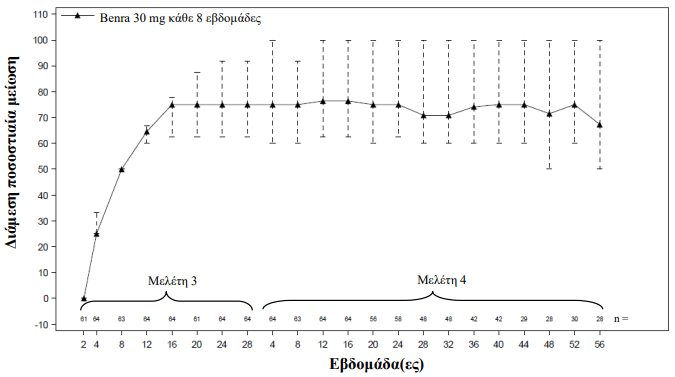
Η διατήρηση της μείωσης της ημερήσιας δόσης των OCS παρατηρήθηκε επίσης κατά τη διάρκεια της μελέτης επέκτασης σε ασθενείς που εντάχθηκαν στη Μελέτη 3 (Εικόνα 1).
Εικόνα 1. Διάμεσες ποσοστιαίες μειώσεις στην ημερήσια δόση OCS με τον χρόνο (Μελέτη 3 και 4)α:
α Ασθενείς της προηγηθείσας Μελέτης 3, οι οποίοι συνέχισαν τη θεραπεία με μπενραλιζουμάμπη στη Μελέτη 4. Στους ασθενείς επιτράπηκε να ενταχθούν σε μία δεύτερη μελέτη επέκτασης μετά από τουλάχιστον 8 εβδομάδες στη Μελέτη 4 χωρίς να ολοκληρώσουν την περίοδο επέκτασης 56 εβδομάδων.
Στη Δοκιμή 5, μια δεύτερη μακροπρόθεσμη μελέτη επέκτασης ασφάλειας (βλ. παράγραφο 4.8), το ετήσιο ποσοστό παροξύνσεων (0,47) σε ασθενείς που έλαβαν το εγκεκριμένο σχήμα δόσης ήταν συγκρίσιμο με αυτό που αναφέρθηκε στις προηγούμενες Δοκιμές 1, 2 (0,65) και 4 (0,48).
Ανοσογονικότητα
Συνολικά, εμφανιζόμενη από τη θεραπεία ανταπόκριση αντισωμάτων κατά του φαρμάκου αναπτύχθηκε σε 107 από τους 809 (13%) ασθενείς υπό θεραπεία με μπενραλιζουμάμπη στο συνιστώμενο σχήμα δόσης κατά τη διάρκεια της περιόδου θεραπείας 48 έως 56 εβδομάδων των φάσης 3, ελεγχόμενων με εικονικό φάρμακο, μελετών παρόξυνσης. Τα περισσότερα αντισώματα ήταν εξουδετερωτικά και επίμονα. Τα αντισώματα κατά της μπενραλιζουμάμπης συσχετίστηκαν με αυξημένη κάθαρση της μπενραλιζουμάμπης και αυξημένα επίπεδα ηωσινοφίλων αίματος σε ασθενείς με υψηλούς τίτλους αντισωμάτων κατά του φαρμάκου σε σύγκριση με ασθενείς αρνητικούς ως προς τα αντισώματα, σε σπάνιες περιπτώσεις, τα επίπεδα ηωσινοφίλων αίματος επανήλθαν στα επίπεδα πριν από τη θεραπεία. Με βάση την τρέχουσα παρακολούθηση των ασθενών, δεν παρατηρήθηκε καμία ένδειξη για συσχέτιση των αντισωμάτων κατά φαρμάκου με την αποτελεσματικότητα ή την ασφάλεια.
Μετά από ένα δεύτερο έτος θεραπείας αυτών των ασθενών από τις φάσης 3 ελεγχόμενες με εικονικό φάρμακο μελέτες, άλλοι 18 από τους 510 (4%) είχαν πρόσφατα αναπτύξει αντισώματα εμφανιζόμενα από τη θεραπεία. Συνολικά, στους ασθενείς που είχαν θετική ανταπόκριση αντισωμάτων κατά του φαρμάκου στις προηγηθείσες μελέτες, οι τίτλοι παρέμειναν σταθεροί ή μειώθηκαν κατά το δεύτερο έτος της θεραπείας. Δεν παρατηρήθηκε καμία ένδειξη συσχέτισης των αντισωμάτων κατά του φαρμάκου με την αποτελεσματικότητα ή την ασφάλεια.
Παιδιατρικός πληθυσμός
Υπήρξαν 108 έφηβοι ηλικίας 12 έως 17 ετών με άσθμα που εντάχθηκαν στις μελέτες φάσης 3 (Μελέτη 1: n=53, Μελέτη 2: n=55). Από αυτούς, 46 έλαβαν εικονικό φάρμακο, 40 έλαβαν μπενραλιζουμάμπη κάθε 4 εβδομάδες για 3 δόσεις, ακολουθούμενη από κάθε 8 εβδομάδες μετέπειτα και 22 έλαβαν μπενραλιζουμάμπη κάθε 4 εβδομάδες. Σε αυτές τις μελέτες, ο ρυθμός παρόξυνσης άσθματος σε εφήβους ασθενείς υπό θεραπεία με μπενραλιζουμάμπη που χορηγήθηκε στο συνιστώμενο σχήμα δόσης ήταν 0,70 (n=40, 95% CI: 0,42, 1,18) σε σύγκριση με 0,41 για το εικονικό φάρμακο (n=46, 95% CI: 0,23, 0,73) [πηλίκο ρυθμού 1,70, 95% CI: 0,78, 3,69].
Οι έφηβοι ασθενείς ηλικίας 12 έως 17 ετών (n=86) από τις Μελέτες 1 και 2 συνέχισαν τη θεραπεία με μπενραλιζουμάμπη στη Μελέτη 4 για διάστημα έως και 108 εβδομάδες. Η αποτελεσματικότητα και η ασφάλεια ήταν συνεπείς με αυτές των προηγούμενων μελετών.
Σε μια ανοιχτής επισήμανσης, μη ελεγχόμενη φαρμακοκινητική και φαρμακοδυναμική μελέτη διάρκειας 48 εβδομάδων σε έναν περιορισμένο αριθμό ασθενών ηλικίας 6 έως 11 ετών (n=28) με μη ελεγχόμενο σοβαρό άσθμα, το μέγεθος της μείωσης των ηωσινόφιλων αίματος ήταν παρόμοιο με αυτό των ενηλίκων και εφήβων.
Δεν μπορεί να εξαχθεί συμπέρασμα σχετικά με την αποτελεσματικότητα στο άσθμα στον παιδιατρικό πληθυσμό (βλέπε παράγραφο 4.2).
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων έχει δώσει αναβολή από την υποχρέωση υποβολής των αποτελεσμάτων των μελετών με τη μπενραλιζουμάμπη σε μία ή περισσότερες υποκατηγορίες του παιδιατρικού πληθυσμού στο άσθμα (βλέπε παράγραφο 4.2 για πληροφορίες σχετικά με την παιδιατρική χρήση).
Φαρμακοκινητική
Η φαρμακοκινητική της μπενραλιζουμάμπης ήταν ανάλογη της δόσης σε ασθενείς με άσθμα έπειτα από υποδόρια χορήγηση σε ένα εύρος δόσεων από 2 έως 200 mg.
Απορρόφηση
Μετά από υποδόρια χορήγηση σε ασθενείς με άσθμα, ο χρόνος ημίσειας ζωής απορρόφησης ήταν 3,5 ημέρες. Με βάση τη φαρμακοκινητική ανάλυση πληθυσμού, η εκτιμώμενη απόλυτη βιοδιαθεσιμότητα ήταν περίπου 59% και δεν υπήρξε κλινικά σημαντική διαφορά στη σχετική βιοδιαθεσιμότητα κατά τη χορήγηση στην κοιλιακή χώρα, τον μηρό ή τον άνω βραχίονα.
Κατανομή
Με βάση τη φαρμακοκινητική ανάλυση πληθυσμού, ο κεντρικός και περιφερικός όγκος κατανομής της μπενραλιζουμάμπης ήταν 3,1 L και 2,5 L αντίστοιχα για ένα άτομο 70 kg.
Βιομετασχηματισμός
Η μπενραλιζουμάμπη είναι ένα ανθρωποποιημένο IgG1 μονοκλωνικό αντίσωμα που αποικοδομείται από πρωτεολυτικά ένζυμα που είναι ευρέως κατανεμημένα στο σώμα και δεν περιορίζονται στον ηπατικό ιστό.
Αποβολή
Από τη φαρμακοκινητική ανάλυση του πληθυσμού, η μπενραλιζουμάμπη εμφάνισε γραμμική φαρμακοκινητική και δεν κατέδειξε κάποια οδό κάθαρσης μεσολαβούμενη από τον υποδοχέα στόχο. Η εκτιμώμενη συστηματική κάθαρση (CL) για τη μπενραλιζουμάμπη ήταν στα 0,29 L/d. Μετά από υποδόρια χορήγηση, ο χρόνος ημίσειας ζωής αποβολής ήταν περίπου 15,5 ημέρες.
Ειδικοί πληθυσμοί
Ηλικιωμένοι ασθενείς (≥65 ετών)
Με βάση τη φαρμακοκινητική ανάλυση πληθυσμού, η ηλικία δεν επηρέασε την κάθαρση της μπενραλιζουμάμπης. Ωστόσο, δεν υπάρχουν διαθέσιμα δεδομένα σε ασθενείς ηλικίας άνω των 75 ετών.
Παιδιατρικός πληθυσμός
Με βάση τη φαρμακοκινητική ανάλυση πληθυσμού και τα δεδομένα κλινικών μελετών, η φαρμακοκινητική της μπενραλιζουμάμπης σε παιδιά και εφήβους ηλικίας 6 έως 17 ετών ήταν σύμφωνη με αυτή των ενηλίκων αφού λήφθηκε υπόψη το σωματικό βάρος όπως ισχύει (βλέπε παράγραφο 4.2).
Φύλο, φυλή
Η φαρμακοκινητική ανάλυση πληθυσμού, έδειξε ότι δεν υπήρξε σημαντική επίδραση του φύλου και της φυλής στην κάθαρση της μπενραλιζουμάμπης.
Νεφρική δυσλειτουργία
Δεν έχουν διεξαχθεί επίσημες κλινικές μελέτες για τη διερεύνηση της επίδρασης της νεφρικής δυσλειτουργίας στη μπενραλιζουμάμπη. Με βάση τη φαρμακοκινητική ανάλυση πληθυσμού, η κάθαρση της μπενραλιζουμάμπης ήταν συγκρίσιμη σε άτομα με τιμές κάθαρσης κρεατινίνης μεταξύ 30 και 80 mL/min και ασθενείς με φυσιολογική νεφρική λειτουργία. Υπάρχουν περιορισμένα διαθέσιμα δεδομένα σε άτομα με τιμές κάθαρσης κρεατινίνης μικρότερες από 30 mL/min. Ωστόσο, η μπενραλιζουμάμπη δεν απομακρύνεται μέσω των νεφρών.
Ηπατική δυσλειτουργία
Δεν έχουν διεξαχθεί επίσημες κλινικές μελέτες για τη διερεύνηση της επίδρασης της ηπατικής δυσλειτουργίας στη μπενραλιζουμάμπη. Τα IgG μονοκλωνικά αντισώματα δεν απομακρύνονται πρωτίστως μέσω της ηπατικής οδού· η μεταβολή της ηπατικής λειτουργίας δεν αναμένεται να επηρεάσει την κάθαρση της μπενραλιζουμάμπης. Με βάση τη φαρμακοκινητική ανάλυση πληθυσμού, οι βιοδείκτες της ηπατικής λειτουργίας (αμινοτρανσφεράση της αλανίνης ALT, ασπαρτική αμινοτρανσφεράση AST και χολερυθρίνη) κατά την έναρξη δεν είχαν κλινικά σημαντική επίδραση στην κάθαρση της μπενραλιζουμάμπης.
Αλληλεπίδραση
Με βάση τη φαρμακοκινητική ανάλυση πληθυσμού, τα συνήθως συγχορηγούμενα φαρμακευτικά προϊόντα (μοντελουκάστη, παρακεταμόλη, αναστολείς αντλίας πρωτονίων, μακρολίδες και θεοφυλλίνη/αμινοφυλλίνη) δεν είχαν καμία επίδραση στην κάθαρση της μπενραλιζουμάμπης σε ασθενείς με άσθμα.
Προκλινικά δεδομένα για την ασφάλεια
Καθώς η μπενραλιζουμάμπη είναι ένα μονοκλωνικό αντίσωμα, δεν έχουν διεξαχθεί μελέτες γονοτοξικότητας ή καρκινογένεσης.
Τοξικολογία σε ζώα και/ή φαρμακολογία
Τα μη κλινικά δεδομένα δεν αποκαλύπτουν ιδιαίτερους κινδύνους για τον άνθρωπο με βάση συμβατικές μελέτες φαρμακολογικής ασφάλειας ή μελέτες τοξικότητας επαναλαμβανόμενων δόσεων σε πιθήκους. Η ενδοφλέβια και υποδόρια χορήγηση σε κυνομόλογους πιθήκους συσχετίστηκε με μειώσεις του αριθμού των ηωσινοφίλων περιφερικού αίματος και μυελού των οστών χωρίς τοξικολογικά ευρήματα.
Κύηση
Σε μια μελέτη προγεννητικής και μεταγεννητικής ανάπτυξης σε έγκυους κυνομόλογους πιθήκους, δεν παρατηρήθηκαν σχετιζόμενες με τη μπενραλιζουμάμπη μητρικές, εμβρυϊκές ή μεταγεννητικές επιδράσεις.
Γονιμότητα
Δεν έχουν διεξαχθεί ειδικές μελέτες σε ζώα. Δεν παρατηρήθηκε καμία έκπτωση σχετιζόμενη με τη μπενραλιζουμάμπη στις αναπαραγωγικές παραμέτρους των αρσενικών και θηλυκών κυνομόλογων πιθήκων. Η εξέταση των αντιπροσωπευτικών παραμέτρων γονιμότητας (συμπεριλαμβανομένων των βαρών των οργάνων και της ιστοπαθολογίας των αναπαραγωγικών ιστών) σε ζώα που έλαβαν μπενραλιζουμάμπη δεν υποδήλωσε έκπτωση της γονιμότητας. Ωστόσο, στους απογόνους των πιθήκων, στους οποίους χορηγήθηκε δόση κατά τη διάρκεια της κύησης, παρατηρήθηκε μείωση των ηωσινοφίλων.
Καρκινογένεση, μεταλλάξεις, στείρωση
Γονιμότητα
Δεν υπάρχουν δεδομένα γονιμότητας στους ανθρώπους. Μελέτες σε ζώα δεν έδειξαν ανεπιθύμητες επιδράσεις της θεραπείας με μπενραλιζουμάμπη στη γονιμότητα (βλέπε παράγραφο 5.3).
Ενεργά συστατικά
|
71492GE1FX - BENRALIZUMAB
|
Σχετικό SPC
Fasenra 30 mg ενέσιμο διάλυμα σε προγεμισμένη σύριγγα.
Fasenra 30 mg ενέσιμο διάλυμα σε προγεμισμένη συσκευή τύπου πένας.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.
ΠΧΠ 2024: FASENRA Ενέσιμο διάλυμα