Φαρμακοδυναμική
Φαρμακοθεραπευτική κατηγορία: ψυχοαναληπτικά, αναστολέας χολινεστεράσης
Κωδικός ATC: Ν06DΑ03
Η rivastigmine είναι ένας αναστολέας της ακετυλο-και βουτυρυλχολινεστεράσης καρβαμικού τύπου, που πιστεύεται ότι διευκολύνει τη χολινεργική νευροδιαβίβαση επιβραδύνοντας την αποικοδόμηση της ακετυλοχολίνης που απελευθερώνεται από όσους χολινεργικούς νευρώνες διατηρούν τη λειτουργικότητά τους. Έτσι, η rivastigmine ενδέχεται να έχει βελτιωτική δράση σε γνωσιακά ελλείμματα χολινεργικής μεσολάβησης στην άνοια σχετιζόμενη με τη νόσο Alzheimer και τη νόσο του Parkinson.
Η rivastigmine αλληλεπιδρά με τα ένζυμα-στόχους της σχηματίζοντας σύμπλοκο ομοιοπολικού δεσμού, με αποτέλεσμα την προσωρινή αδρανοποίηση των ενζύμων. Σε νεαρούς υγιείς ανθρώπους, μία από του στόματος δόση 3 mg μειώνει τη δράση της ακετυλοχολινεστεράσης (AChE) στο εγκεφαλονωτιαίο υγρό κατά περίπου 40% εντός των πρώτων 1,5 ωρών μετά τη χορήγηση. Η δραστικότητα του ενζύμου επανέρχεται στα αρχικά της επίπεδα περίπου 9 ώρες μετά την επίτευξη του μέγιστου ανασταλτικού αποτελέσματος. Σε ασθενείς με Νόσο Alzheimer, η αναστολή της AChE στο εγκεφαλονωτιαίο υγρό από την rivastigmine ήταν δοσοεξαρτώμενη έως τα 6 mg χορηγούμενη δύο φορές ημερησίως, που είναι και η μέγιστη δόση που έχει δοκιμασθεί. Η αναστολή της δράσης της βουτυρυλχολινεστεράσης στο εγκεφαλονωτιαίο υγρό 14 ασθενών με Νόσο Alzheimer με αγωγή με rivastigmine ήταν όμοια με αυτή της AChE.
Κλινικές Μελέτες στην άνοια της νόσου Alzheimer
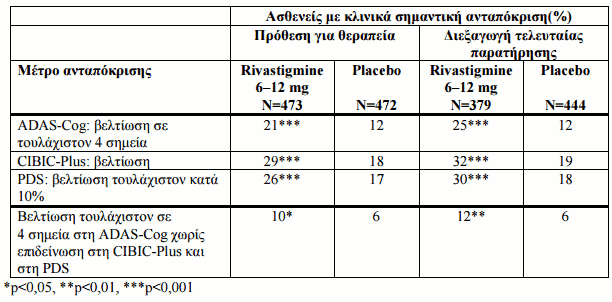
Η αποτελεσματικότητα της rivastigmine έχει καταδειχθεί με την χρήση τριών ανεξάρτητων, για συγκεκριμένους τομείς εργαλείων αξιολόγησης που αξιολογήθηκαν σε ανά περιοδικά διαστήματα στη διάρκεια των εξαμηνιαίων θεραπευτικών περιόδων. Στα εργαλεία αυτά συμπεριλαμβάνονται: η ADAS-Cog (Alzheimer’s Disease Assessment Scale – Cognitive subscale, μια δοκιμασία με βάση την απόδοση, που αποτελεί μέτρο της γνωστικής λειτουργίας), η CIBIC-Pluss (Clinician’s Interview Based Impression of Change-Plus, μια πλήρης ολική αξιολόγηση του ασθενούς από τον ιατρό, όπου λαμβάνονται υπ'όψιν στοιχεία που δίνονται από το άτομο που φροντίζει τον ασθενή) και η PDS (Progressive Deterioration Scale, μια αξιολόγηση από το άτομο που φροντίζει τον ασθενή των δραστηριοτήτων της καθημερινής ζωής στις οποίες συμπεριλαμβάνονται η προσωπική υγιεινή, η λήψη τροφής, το ντύσιμο, οι δουλειές του νοικοκυριού όπως τα ψώνια, η διατήρηση της ικανότητας προσανατολισμού στο περιβάλλον, καθώς και η συμμετοχή σε δραστηριότητες που σχετίζονται με την ικανότητα χειρισμού χρημάτων κ.λ.π.).
Οι ασθενείς που μελετήθηκαν είχαν βαθμολογία MMSE (Εξέταση Ελάχιστης-Νοητικής Κατάστασης) 10-24.
Τα συγκεντρωτικά αποτελέσματα που αναφέρονται στους ασθενείς οι οποίοι επέδειξαν κλινικώς σημαντική ανταπόκριση, όπως αυτά προέκυψαν από τις 2 μελέτες με ευπροσάρμοστη δοσολογία από τις 3 βασικές πολυκεντρικές μελέτες διάρκειας 26 εβδομάδων σε ασθενείς για την ήπια έως μετρίως σοβαρή άνοια επί νόσου Alzheimer παρουσιάζονται στον παρακάτω Πίνακα 4. Κλινικά σημαντική βελτίωση σε αυτές τις μελέτες ορίστηκε a apriori ως η βελτίωση σε τουλάχιστον 4 σημεία στην ADAS-Cog, βελτίωση στην CIBIC-Plus ή τουλάχιστον 10% βελτίωση στη PDS.
Επιπρόσθετα, ένας μετέπειτα ορισμός της ανταπόκρισης παρουσιάζεται στον ίδιο πίνακα. Ο δεύτερος ορισμός της ανταπόκρισης προϋποθέτει βελτίωση σε 4 σημεία ή περισσότερα στην ADAS-Cog, καμιά επιδείνωση στην CIBIC-Plus και καμιά επιδείνωση στη PDS.H μέση πραγματική ημερήσια δόση για αυτούς που ανταποκρίνονται στην ομάδα των 6-12 mg, σύμφωνα με αυτόν τον ορισμό, ήταν 9,3 mg. Είναι σημαντικό να σημειωθεί ότι οι κλίμακες που χρησιμοποιήθηκαν σε αυτήν την ένδειξη ποικίλλουν και άμεσες συγκρίσεις των αποτελεσμάτων για διαφορετικούς θεραπευτικούς παράγοντες δεν έχουν ισχύ.
Πίνακας 4:
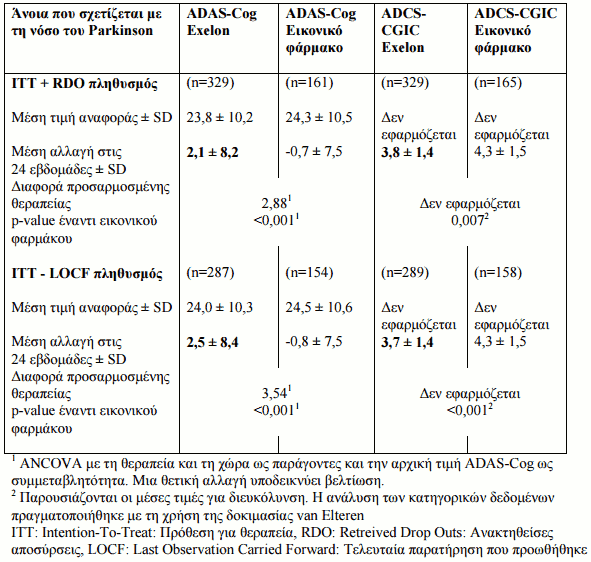
Κλινικές μελέτες στην άνοια που σχετίζεται με τη νόσο του Parkinson
Η αποτελεσματικότητα της rivastigmine στην άνοια που σχετίζεται με τη νόσο του Parkinson έχει αποδειχτεί σε μια 24-εβδομάδων πολυκεντρική, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο αρχική μελέτη και στην ανοιχτή 24-εβδομάδων φάση επέκτασης της. Οι ασθενείς που συμμετείχαν σε αυτή τη μελέτη είχαν βαθμολογία MMSE (Εξέταση Ελάχιστης-Νοητικής Κατάστασης) 10-24. Η αποτελεσματικότητα έχει αποδειχτεί με την χρήση δύο ανεξάρτητων κλιμάκων οι οποίες αξιολογούνταν σε τακτά χρονικά διαστήματα κατά την διάρκεια της 6-μηνης περιόδου θεραπείας όπως φαίνεται στον Πίνακα 5 παρακάτω: το ADAS-Cog, η μέτρηση της γνωστικής λειτουργίας και η συνολική μέτρηση ADCS-CGIC (Alzheimer’s Disease Cooperative Study-Clinician’s Global Impression of Change).
Πίνακας 5:
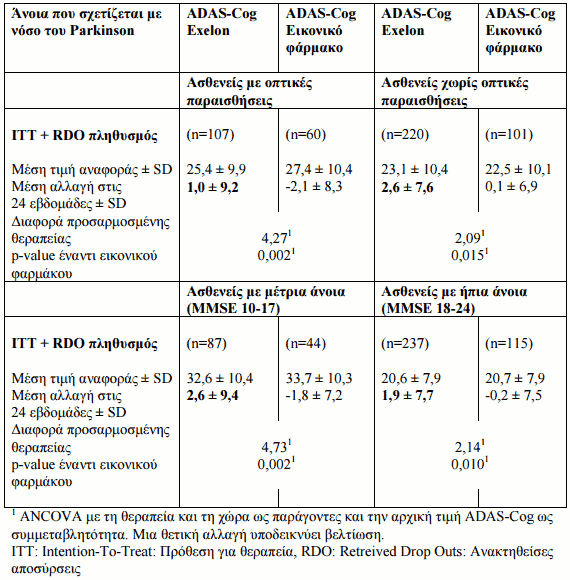
Παρόλο που η θεραπευτική δράση αποδείχθηκε σε όλο τον πληθυσμό της μελέτης, τα δεδομένα υποδηλώνουν ότι το μεγαλύτερο θεραπευτικό αποτέλεσμα σε σχέση με το εικονικό φάρμακο φάνηκε στην υποκατηγορία ασθενών με μέτρια άνοια που σχετίζεται με νόσο του Parkinson. Ομοίως το μεγαλύτερο θεραπευτικό αποτέλεσμα παρατηρήθηκε σε αυτούς τους ασθενείς με οπτικές παραισθήσεις (βλ. Πίνακα 6).
Πίνακας 6:
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων έχει δώσει απαλλαγή από την υποχρέωση υποβολής των αποτελεσμάτων των μελετών με το Exelon σε όλες τις υποκατηγορίες του παιδιατρικού πληθυσμού στην θεραπεία της άνοιας Alzheimer και άνοιας σε ασθενείς με ιδιοπαθή νόσο του Parkinson (βλ. παράγραφο 4.2 για πληροφορίες σχετικά με την παιδιατρική χρήση).
Φαρμακοκινητική
Απορρόφηση
Η rivastigmine απορροφάται ταχέως και πλήρως. Οι μέγιστες συγκεντρώσεις της στο πλάσμα επιτυγχάνονται εντός 1 ώρας περίπου. Ως αποτέλεσμα της αλληλεπίδρασης της rivastigmine με το ένζυμο-στόχο, η αύξηση της βιοδιαθεσιμότητας είναι αυξημένη κατά περίπου 1,5 φορά σε σύγκριση με εκείνη που αναμένεται με βάση την αύξηση της δόσης. Η απόλυτη βιοδιαθεσιμότητα ύστερα από μία δόση των 3 mg είναι περίπου 36% ± 13%. Η χορήγηση rivastigmine μαζί με το φαγητό καθυστερεί την απορρόφηση (tmax) κατά 90 λεπτά, ενώ μειώνει την Cmax και αυξάνει την AUC κατά περίπου 30%.
Κατανομή
Η πρωτεϊνική δέσμευση της rivastigmine είναι σε ποσοστό περίπου 40%. Διαπερνά εύκολα τον αιματεγκεφαλικό φραγμό και έχει φαινομενικό όγκο κατανομής μεταξύ 1,8 και 2,7 l/kg.
Βιομετασχηματισμός
Η rivastigmine μεταβολίζεται ταχέως και εκτενώς (χρόνος ημισείας ζωής στο πλάσμα περίπου 1 ώρα), κυρίως μέσω υδρόλυσης με μεσολάβηση χολινεστεράσης, προς το αποκαρβαμυλιωμένο μεταβολίτη. In vitro, ο μεταβολίτης αυτός αναστέλλει την ακετυλοχολινεστεράση σε περιορισμένο βαθμό (<10%).
Σύμφωνα με in vitro μελέτες, δεν αναμένεται καμία φαρμακοκινητική αλληλεπίδραση με φαρμακευτικά προϊοντα που μεταβολίζονται από τα ακόλουθα ισοένζυμα του κυτοχρώματος CYP1A2, CYP2D6, CYP3A4/5, CYP2E1, CYP2C9, CYP2C8, CYP2C19, ή CYP2B6. Σύμφωνα με ενδείξεις από μελέτες που έγιναν σε πειραματόζωα, τα μείζονα ισοένζυμα του κυτοχρώματος P450 ελάχιστα ενέχονται στο μεταβολισμό της rivastigmine. Η ολική κάθαρση της rivastigmine από το πλάσμα ήταν περίπου 130 l/h μετά την ενδοφλέβια χορήγηση δόσης 0,2 mg, ενώ μειώθηκε σε 70 l/h μετά την ενδοφλέβια χορήγηση δόσης 2,7 mg.
Αποβολή
Στα ούρα δεν ανευρίσκεται αμετάβλητη rivastigmine. Η νεφρική απέκκριση των μεταβολιτών είναι η βασική οδός απομάκρυνσής τους. Ύστερα από τη χορήγηση rivastigmine ραδιοεπισημασμένης με 14C, η απέκκριση από τους νεφρούς ήταν ταχεία και ουσιαστικά πλήρης (>90%) εντός 24 ωρών. Ποσοστό χαμηλότερο από το 1% της χορηγούμενης δόσης απεκκρίνεται στα κόπρανα. Δεν παρατηρείται συσσώρευση της rivastigmine ή του αποκαρβαμυλιωμένου μεταβολίτη της σε ασθενείς με Νόσο Alzheimer.
Μια φαρμακοκινητική ανάλυση του πληθυσμού έδειξε ότι η επακόλουθη χρήση νικοτίνης μετά από δοσή μέχρι και 12 mg/ημέρα rivastigmine από του στόματος καψάκια, αυξάνει την από του στόματος κάθαρση της rivastigmine κατά 23% στους ασθενείς με άνοια Alzheimer (n=75 καπνιστές και 549 μη-καπνιστές).
Ειδικοί πληθυσμοί
Ηλικιωμένοι
Μολονότι η βιοδιαθεσιμότητα της rivastigmine είναι μεγαλύτερη σε ηλικιωμένους παρά σε νεαρούς υγιείς εθελοντές, μελέτες σε ασθενείς με νόσο Alzheimer ηλικίας μεταξύ 50 και 92 ετών δεν έδειξαν μεταβολή της βιοδιαθεσιμότητας με την ηλικία.
Ηπατική δυσλειτουργία
Η Cmax της rivastigmine ήταν περίπου 60% υψηλότερη και η AUC της rivastigmine ήταν υπερδιπλάσια σε άτομα με ήπια έως μέτρια ηπατική δυσλειτουργία από ότι σε υγιή άτομα.
Νεφρική δυσλειτουργία
Η Cmax και η AUC της rivastigmine ήταν υπερδιπλάσιες σε άτομα με μέτρια νεφρική δυσλειτουργία συγκρινόμενη με υγιή άτομα. Πάντως δεν παρατηρήθηκαν αλλαγές στη Cmax και στη AUC της rivastigmine σε άτομα με σοβαρή επιβάρυνση της νεφρικής λειτουργίας.
Προκλινικά δεδομένα για την ασφάλεια
Μελέτες τοξικότητας επαναλαμβανόμενων δόσεων σε επίμυες, ποντικούς και σκύλους αποκάλυψαν μόνο επιδράσεις συνδεόμενες με υπερβολική φαρμακολογική δράση. Δεν παρατηρήθηκε καμία τοξική δράση στο όργανο-στόχο. Στις μελέτες σε πειραματόζωα δεν επιτεύχθηκαν τα περιθώρια ασφαλείας ως προς την ανθρώπινη έκθεση, λόγω της ευαισθησίας των πειραματικών μοντέλων που χρησιμοποιήθηκαν.
Η rivastigmine δεν είχε μεταλλαξιογόνο δράση σε μια σειρά από τυπικές δοκιμασίες in vitro και in vivo, με μόνη εξαίρεση μία δοκιμασία χρωμοσωματικών εκτοπιών που έγινε σε ανθρώπινα περιφερικά λεμφοκύτταρα, σε δόση 104 φορές μεγαλύτερη από τη μέγιστη κλινική έκθεση. Η in vivo δοκιμασία μικροπυρήνων ήταν αρνητική. Ο κύριος μεταβολίτης NAP226-90 δεν παρουσίασε επίσης δυναμικό γονιδιοτοξικότητος.
Δεν βρέθηκαν ενδείξεις καρκινογόνου δράσης σε μελέτες που έγιναν σε ποντικούς και επίμυες με τη μέγιστη ανεκτή δόση, παρόλο που η έκθεση στη rivastigmine και τους μεταβολίτες της ήταν χαμηλότερη από την έκθεση στον άνθρωπο. Όταν έγινε κανονικοποίηση ως προς την επιφάνεια σώματος, η έκθεση στη rivastigmine και τους μεταβολίτες της ήταν περίπου ισοδύναμη προς τη μέγιστη συνιστώμενη ημερήσια δόση για τον άνθρωπο, που είναι 12 mg/ημέρα. Πάντως, σε σύγκριση με τη μέγιστη δόση στον άνθρωπο, εκείνη που επιτεύχθηκε στα πειραματόζωα ήταν περίπου εξαπλάσια.
Στα πειραματόζωα, η rivastigmine διαπερνά τον πλακούντα και απεκκρίνεται στο γάλα. Μελέτες με από του στόματος χορήγηση σε κυοφορούντες θηλυκούς επίμυες και κονίκλους δεν έδωσαν ενδείξεις πιθανής τερατογόνου δράσης της rivastigmine. Σε από του στόματος μελέτες με αρσενικούς και θηλυκούς επίμυες, δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες της rivastigmine στη γονιμότητα ή στην αναπαραγωγική απόδοση είτε στη μητρική γενεά είτε στους απογόνους της.
Σε μια μελέτη με κονίκλους ταυτοποιήθηκε η δυνητικότητα ενός ήπιου ερεθισμού στα μάτια/βλεννογόνο της rivastigmine.
Καρκινογένεση, μεταλλάξεις, στείρωση
Γονιμότητα
Δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες στη γονιμότητα ή στην αναπαραγωγική απόδοση σε επίμυες (βλ. παράγραφο 5.3). Οι επιδράσεις της rivastigmine στην ανθρώπινη γονιμότητα δεν είναι γνωστές.
Ενεργά συστατικά
|
9IY2357JPE - RIVASTIGMINE TARTRATE
|
Σχετικό SPC
Exelon 1,5 mg σκληρά καψάκια.
Exelon 3,0 mg σκληρά καψάκια.
Exelon 4,5 mg σκληρά καψάκια.
Exelon 6,0 mg σκληρά καψάκια.
Το πηγαίο έγγραφο είναι διαθέσιμο προς ανάγνωση ή μεταφόρτωση από τους συνδρομητές.